Никотиндік агонист - Википедия - Nicotinic agonist
A никотиникалық агонист әрекетін имитациялайтын препарат болып табылады ацетилхолин (ACh) сағ никотиндік ацетилхолинді рецепторлар (nAChR). NAChR никотинге жақын екендігі үшін аталған.
Мысалдарға мыналар жатады никотин (анықтама бойынша), ацетилхолин ( эндогендік агонист nAChR), холин, эпибатидин, лобелин, варениклин және цитизин.
Тарих

Никотин ғасырлар бойы өзінің мас ететін әсерімен танымал. Ол алғаш рет 1828 жылы оқшауланған темекі зауыты неміс химиктері Поссельт пен Рейман.[1]
Никотиннен жануарлардың есте сақтау қабілетіне оң әсерін ашты in vivo 1980 жылдардың ортасында жүргізілген зерттеулер. Бұл зерттеулер никотиндік ацетилхолиндік рецепторларды (nAChR) және оларды ынталандыруды зерттеуде жаңа дәуірге әкелді, бірақ сол уақытқа дейін никотинге тәуелділікке баса назар аударылды.[2][3] NAChR агонистерінің дамуы 1990-шы жылдардың басында никотиннің оң әсерлері табылғаннан кейін басталды. Кейбір зерттеулер клиникаға дейінгі зерттеулерде мүмкін болатын терапия нұсқасын көрсетті. ABT-418 nAChR агонистерінің алғашқыларының бірі болды және оны құрастырған Abbott Labs.[3] ABT-418 жетілдірілген үлгіге (DMTS) кешіктірілген өнімділіктің айтарлықтай өсуін көрсетті макака маймылдары әртүрлі түрлер мен жыныстар.[4] ABT-418 сонымен қатар Альцгеймер ауруы, Паркинсон ауруы және назар тапшылығы гиперактивтілігінің бұзылуы мүмкін ем ретінде қарастырылды: бұл тәжірибелер оң нәтиже көрсетті.[3]
Наркотик ретінде сатылатын никотиннен басқа алғашқы nAChR белсенді қосылыстарының бірі болды галантамин, өсімдік алкалоид әлсіз ретінде жұмыс істейді холинэстераза ингибиторы (IC50 = 5µM), сондай-ақ nAChRs үшін аллостериялық сенсибилизатор (EC50 = 50 нМ).[5]
Никотиндік ацетилхолинді рецепторлар және олардың сигналдық жүйесі

Сигнал жүйесі
Адамда жүйке жүйесі никотиндік холинергиялық сигналдар бүкіл жүйеге таралады, мұнда ацетилхолин нейротрансмиттері (ACh) негізгі рөл атқарады лигандты ионды каналдар.[6] Холинергиялық жүйе - бұл өмірлік маңызды жүйелік жол, мұнда холинергиялық нейрондар ACh нейротрансмиттерін синтездейді, сақтайды және босатады. ACh хабарламаларын түрлендіретін негізгі рецепторлар холинергиялық болып табылады мускариндік ацетилхолинді рецепторлар, нейрондық және бұлшықет nAChR. Эволюциялық тарихқа көз жүгіртсек, ACh ең көне таратқыш молекула болып саналады және жүйке жасушасының алдында болған. Жүйке жүйесінде nAChR арқылы қозғалатын холинергиялық ынталандыру физиологиялық белсенділікке, ұйқылыққа, мазасыздыққа, ауруды өңдеуге және когнитивті функцияларға әсер етуі мүмкін таратқыштардың бөлінуі және жасушалардың сезімталдығы сияқты жолдарды басқарады.[7]
Никотиндік ацетилхолинді рецепторлар
nAChR бар холинергиялық орталық жүйке жүйесінде (ОЖЖ), шеткі жүйке жүйелерінде (PNS) және қаңқа бұлшықеттерінде кездесетін рецепторлар, бұл рецепторлар ацетилхолин және басқа молекулалар үшін байланысатын жерлері бар лиганд-иондық арналар. ACh немесе басқа агонистер рецепторлармен байланысқан кезде, калий, кальций және натрий иондары сияқты катиондардың ағуына мүмкіндік беретін ион каналының ашық күйін тұрақтандырады. NAChR-ді анықтайтын әр түрлі бөлімшелер құрайды төрттік құрылым рецептордың, бұл суббірліктер α суббірліктер (α1 − α10), β суббірліктер (β1 − β4), бір δ суббірлік, бір γ суббірлік және бір ε суббірлік. nAChR болуы мүмкін гетеромерлі немесе гомомериялық. Орталық жүйке жүйесінде кездесетін гетеромериялық рецепторларды екі α суббірлік және үш β суббірлік α мен оған іргелес суббірліктің түйісу нүктесіндегі байланыс орнымен құрайды. Бұл рецепторларда бір рецепторда екі байланыс орны болады және суббірліктердің құрамына негізделген химиялық заттарға әр түрлі жақындығы бар. Екі байланыстырушы торап та бірге жұмыс істейді, демек, екі сайтты да nAChR агонистімен қамту керек, сонда арнаны іске қосу мүмкін болады.[8] Құрамында α2 − α6 және β2 − β4 бірліктері бар nAChR-дің басқа рецепторларға қарағанда ACh-қа жақындығы жоғары екендігі дәлелденді. Гомомериялық рецепторларда 5 бірдей суббірлік бар, олардың екі іргелес суббірліктердің шекарасында орналасқан 5 байланыс алаңдары бар. 2000 жылы адамдарда екі гомомериялық рецепторлар - α7 және α8 рецепторлары анықталды.[7][9][10][11]
Тұтастыратын сайт
Гетеромерлі nAChR-де екі байланыстыру орны бар; nAChR-дің ашық түрін тұрақтандыру үшін екі байланыстырушы учаскені никотин немесе ACh сияқты агонист иеленуі керек.[10]
NAChR-дің ACh байланыстыратын орны алты циклдан тұрады, оларды A-F деп атайды. Байланыстыру учаскесінің A, B және C циклдары α суббірліктің бөлігі болып табылады және байланыстыру учаскесінің негізгі компоненттері болып табылады. Α суббірлікке (γ, δ, ε немесе β) іргелес суббірлікте D, E және F циклдары бар.[10]
Қимыл механизмі

α4β2 рецепторлық агонистер
α4β2 nAChR құрамында екі α4 суббірлік және үш β2 суббірлік болады, сондықтан оның ACh және басқалары үшін екі байланыстыру орны бар агонистер. α4β2 nAChR адам миындағы шамамен 90% nAChR құрайды және никотинге немесе басқа никотин агонистеріне созылмалы әсер еткенде α4β2 рецепторларының тығыздығының өсуіне әкеледі, бұл басқа рецепторлар агонистерге созылмалы әсер еткенде керісінше болады. Α4β2 рецепторы Альцгеймер ауруына қатысты, сондай-ақ никотинге тәуелділік бойынша кеңінен зерттелген және 2009 жылы нарықта α4β2 nAChR-ны мақсатты бірнеше дәрі-дәрмектер бар.[12][13]
α7 рецепторлық агонистер
α7 рецепторлары - бұл бес α7 суббірліктен тұратын және бес ACh байланысатын учаскелерден тұратын гомомерлі нейрондық ацетилхолинді рецепторлар. Α7 рецепторларының экспрессиясындағы ауытқулар Альцгеймер ауруы және сияқты аурулардың өршуіне әсер етеді деп хабарланды. шизофрения. Α7 никотинге гетеромериялық рецептор сияқты жақындыққа ие деп санамайды, бірақ оның орнына олар жақындықты көрсетті альфа бунгаротоксин бұл кейбір жыландардың уында болатын никотиндік антагонист. Α7 рецепторларын бағыттау Альцгеймер ауруы мен шизофренияны емдеуде пайдалы деп саналады.[8][14]
Бұлшықет түріндегі рецепторлық агонистер
nAChR анықталады жүйке-бұлшықет қосылысы қаңқа бұлшықеттерінде. Екі түрлі рецепторлар табылды, олардың біреуі, ең алдымен, ересектерде табылған екі α1 суббірліктен тұрады, бірі β1, бірі ε және бірі one, екіншісі ұрықта кездеседі және ε суббірліктің орнына γ суббірлік болады. NAChR қатысады деполяризация қаңқа бұлшықеттерінің жиырылуына әкелетін катион өткізгіштігін жоғарылату арқылы бұлшық ет ұшының.[15] Қаңқа бұлшықет жүйесінде кездесетін nAChR-дің екі ACh байланыстыру орны бар, олардың біреуі α1 және δ суббірліктері арасында, ал екіншісі α1 және γ немесе ε суббірліктері арасында кездеседі. Жүйке-бұлшықет жүйесі үшін арнайы жасалған nAChR антагонистерінің ішінде жүйке газдары және адамдарды немесе басқа жануарлар мен жәндіктерді тез жоюға арналған улар бар.[11]
Міндетті
ACh рецептор беті мен молекуласының арасындағы айырмашылыққа байланысты nAChR-мен байланысады. NAChR-мен байланысқан кезде ACh α суббірлікке және іргелес суббірлікке жататын A, B және C ілмектерімен пішінделген қалтаға сәйкес келеді. ACh байланыстырушы қалтаға салынған кезде nAChR ілмектері қозғалысқа түседі, нәтижесінде молекула мен рецептор арасындағы химиялық байланыстар күшейіп, қалтадағы ACh молекуласының координациясы жүреді. Α суббірлікке жататын ілмектер қозғалғаннан кейін кейде ACh молекуласы байланыс түзуі мүмкін, мысалы. рецептор мен ACh байланыстарын одан әрі күшейтетін іргелес суббірлікке тұзды көпір.[16]
Есірткінің дизайны
NAChR әсер ететін дәрілер агонистер, жартылай агонисттер немесе болуы мүмкін антагонисттер. Агонисттер, мысалы. никотин, дегенмен, біраз уақыт nAChR-мен кездескенде деполяризациялаушы агент ретінде әрекет етуі мүмкін (концентрацияға және nAChR кіші түріне байланысты секундтар немесе минуттар), агонистің созылмалы әсер етуі, сонымен қатар тез және тұрақты десенсибилизацияның әсерінен ұзаққа созылатын функционалды дезактивацияға әкелуі мүмкін. Ішінара nAChR агонистері зерттелді, өйткені олар темекі шегуден бас тартуға көмектеседі. Ішінара агонистер nAChR-мен байланысады және олардың бөлінуін ынталандырады деп саналады дофамин агонистерге қарағанда кішірек бөліктерде, сондықтан никотиннің болмауын өтейді.[17]
Кейбір никотиндік агонистердің спецификасының болмауы белгілі және оларды nAChR-дің белгілі бір кіші түріне бағыттауды қажет ететін ауруларды емдеу үшін қолдану мүмкін проблема болып табылады. Бұл ерекше емес агонистердің қатарына ACh, никотин және эпибатидин барлығы nAChR бірнеше түрін мақсат етеді.[18]
Фармакофор

NAChR агонистін дамыту фармакофор 1970 жылы агонистердің рецептормен байланысы оң зарядталған азот атомына және ацетилхолиндегі карбонил оттегі атомынан немесе (S) -никотиндегі азот атомынан түзілетін сутегі байланысына тәуелді болады деген ұсыныс жасалды. Содан бері катиондық орталық, электрегативті және (S) -никотиндегі пиридин сақинасының центрімен бірге сутегі байланыстарын құруға қабілетті атомдар қолайлы екендігі дәлелденді. Стереохимия (S) - және (R) - никотинмен айқын көрінетін фармакофордың бөлігі болып табылады, мұндағы (S) -энантиомер 10-100 есе күшті. Эпибатидиннің азабициклді сақинасы рецепторлармен қолайлы стерикалық өзара әрекеттесудің тағы бір мысалы болып табылады. Белгілі бір интертерогендік қашықтық N деп ұсынылды+-N, агонистік жақындығы үшін маңызды, бірақ оның әсеріне қатысты пікірталастар туындады. Протонирленген азот атомы мен сутегі байланысының акцепторын толықтыратын нүктелер арасындағы 7-8 Å қашықтық потенциалды жақсартады деген жаңа теория. Төмен электронды тығыздық Протонды азотқа жақын және пиридин сақинасына жақын электрондардың тығыздығы протонды никотинге жақсырақ лигандтар құрамында пиридин сақинасы. Кейінгі жылдары зерттеушілер никотинге тәуелділікті және Альцгеймер сияқты когнитивті бұзылуларды емдеу үшін есірткіні дамытудағы α7 және α4β2 типтік рецепторларына көбірек қызығушылық танытты.[19]
Құрылымдық-қызметтік қатынастар
Құрылымдық-белсенділік қатынастары: бұлшықет nAChR агонистері
NAChR агонистерінің рецепторлардың кіші түріне жақындығын тексеруге мүмкіндік беретін әр түрлі модельдер жасалды, олар жақындық үшін өте маңызды молекулаларды, топтарды және стерикалық конформацияны анықтауға көмектеседі. NAChR бұлшықет рецепторының кіші түрін қолдану арқылы (α1)2β1δγ моделі бойынша келесі нәтижелер алынды:
мұнда анатоксиннің белсенділігі ең жоғары, ал тубокурар ең төменгі деңгейге ие болды. Ацетилхолин рецептордың ашылу уақытын едәуір ұзартты, дегенмен анатоксин күштірек. Нәтижелер анатоксиннің туындылары бұлшықет nAChR үшін құрылымдық-белсенділік қатынастарды (SAR) түсіну үшін пайдалы болады деп болжайды.[20]
Сукцинилхолин хлориді, бұл нарықта бұрыннан бар препарат, бұл бишолин эфирі және бұлшықет босаңсытқышы. Бисхолин эфирлері - бұлшықет типіндегі nAChR-да бәсекеге қабілетті агонист бола алатын және SAR зерттеулерінде қолданылған қосылыстар. Ішінде Торпедо (α1)2AC1δγ nAChR моделі бойынша, бишолин эфирінің агонистерінің потенциалы тізбектің ұзындығына тәуелді екендігі дәлелденді, өйткені потенциал ұзын тізбектермен өседі. Тиімділік тізбектің ұзындығына тәуелді емес сияқты, өйткені ең жоғары тиімділік төрт-жетіден тұратын бишолин эфирлерінде байқалады CH
2 бірлік және екеуі үшін төмен CH
2 бірлік және басқалары.[21]
Құрылымдық-белсенділік қатынастары: α4β2 nAChR агонистері

Ач және никотиннің құрылымдық элементтерін біріктіру, сонымен қатар циклопропан сақинасын қолдану арқылы конформациялық икемділікті төмендету күшті және селективті α4β2 nAChR лигандаларын ашуға әкелді. Лигандтардың потенциалы мен селективтілігіне әсерін анықтау үшін аминқышқылдағы және пиридин сақинасындағы үш құрылымдық элементтің, байланыстырғыштың, модуляциясының модуляциясын қолдануға болады. Байланысты төмендететін факторлар амин тобына стерикалық кедергі болып табылады және қаныққан / қанықпаған көміртегі тізбектері болып табылатын байланыстырушылар. Қысқа тізбекті эфир байланыстырғыштарына артықшылық беріледі. Байланыстыруға пайдалы әсер пиридин сақинасында моно- және галогендермен басқа топтар арасында дисбутация болған кезде орын алады. Үш түрлі амидті амин тобына ауыстыру метиламидтің байланысуы жоғары болатын байланыстырушы жақындығын арттырды. Басқа алмастырылған амидтердегі төменгі байланыс стерикалық кедергі немесе метил тобының болмауымен түсіндірілді, нәтижесінде гидрофобты өзара әрекеттесу жоғалады. Пиридин азотының және / немесе пиридин сақинасының стереохимиясы және оның стереоэлектронды әсерлері α4β2 nAChR байланыстырылуына әсерлі әсер етеді. Осылайша, пиридинге бромды алмастыратын пиридил эфир лигандының және амин тобындағы метилатедамидтің ең жоғары потенциалы көрсетілген.[22]
Құрылымдық-белсенділік қатынастары: α7 nAChR агонистері

Селективті және күшті α7 nAChR агонистерін іздеу нәтижесінде есірткіге үміткер ретінде жақсы потенциалы бар бірқатар қосылыстар түзілді. Осындай іздеудің бірі пайда болды SEN12333 / WAY-317538 басқа қосылыстардың арасында қажет фармакокинетикалық профильдер және α7 nAChR-ді α1, α3 және α4β2 nAChR-ден асып алады. Осы қосылыстардың құрылымдық белсенділік қатынастары ұсынылды.[14] Α7 nAChR агонистінің оңтайлы фармакофоры үш бөліктен тұрады. Хош иісті бөлікке амидті көпірмен байланысқан көміртегі тізбегіне қосылған негізгі бөлік бар. Амидтік көпірді агонистің күшіне әсер етпестен аударуға болады. A biарыл тобы моноарил тобына қарағанда әлдеқайда күшті көрсетеді, өйткені хош иісті бөлік және кейінгі арил тобындағы 2-позицияда алмастыру потенциалды одан әрі арттырады. Н-мен агонистер үшін потенциал жоғары+ биарил тобындағы кейінгі арил тобындағы донор / акцептор. Жоғары саны сутегі байланысы акцепторлар өткізгіштік қабілетін төмендетуі мүмкін қан-ми тосқауылы (BBB) полярлық беткейге байланысты және агонистерді α7 nAChR мақсатына жобалау кезінде ескеру қажет.[14]
Әр түрлі циклдік амин топтар негізгі бөлік ретінде әрекет ете алады және потенциал салыстырмалы түрде өзгермейді, мысалы, арил пиперазин, пиперидин және морфолин. Ациклді үшінші аминге негізгі бөлік ретінде төзімді, бірақ үлкен стерикалық топтарға аз төзімді.[14]
Көптеген туындылары хинуклидин мысалы хинуклидин амидінің α7 nAChR агонистері екендігі белгілі. Хинуклидин амидіне арналған SAR зерттеулері осы агонистердің күші мен жақындығына әсер ететін факторларды анықтады. Стереохимияда хинуклидин сақинасында және 3- (R) конфигурациясында параны ауыстыру қолайлы. Жақсартылған белсенділік 5 мүшелі сақина хош иісті бөлікке біріктірілген кезде байқалады. Балқытылған сақина амид карбониліне электронды резонанс бере алатын кезде одан әрі күшейе түседі, ал балқытылған сақинада сутектік байланыстың донорлық атомы болған кезде белсенділігі төмендейді. Амин карбонил тобына қатынаста хинуклидиннің қаттылығы және азот көпірінің ортогоналды бағыттылығы оңтайлы байланыс үшін маңызды болып саналады. Егеуқұйрықтағы кейбір күшті хинуклидин амид туындыларының тұрақтылығы in vitro модельдер төмен болды, бірақ хинуклидин сақинасындағы 2-орынға метил тобын қосу арқылы тұрақтылық айтарлықтай өсті.[23]
Есірткіні дамыту
Никотиндік ацетилхолиндік рецепторлық агонистердің дамуы 1990-шы жылдардың басында никотиннің жануарлар жадына жағымды әсерлері анықталғаннан кейін басталды.[2][3] Сол кезден бастап никотиндік ацетилхолин рецепторлары агонистерінің дамуы ұзақ жолдан өтті. Никотиндік ацетилхолин рецепторларының агонистері орталық жүйке жүйесінің көптеген бұзылыстары үшін есірткіге үміткер ретінде көбірек назар аударуда. Альцгеймер ауруы, шизофрения, назар тапшылығының гиперактивтілігінің бұзылуы (ADHD) және никотинге тәуелділік.[24][25] Никотиндік ацетилхолинді рецепторлар табылған рецепторлар болып табылады орталық жүйке жүйесі, перифериялық жүйке жүйесі және қаңқа бұлшықеттері. Олар ионды лиганд-қақпалы арналар байланыстыратын тораптар үшін ацетилхолин басқа да агонистер. Агонисттер а рецептор ол ион каналының ағып кетуіне мүмкіндік беретін ашық күйін тұрақтандырады катиондар.[8]
2009 жылы нарықта никотиндік ацетилхолин рецепторларына әсер ететін кем дегенде бес дәрі болды.
 |  |  |
| Хинуклидинді карбаматтар | Хинуклидин амидтері | Хинуклидин эфирлері |
Никотиндік агонистің өнімі
| Белсенді ингредиент | Өнімнің атауы | Химиялық атауы | Фармацевтикалық форма | Фармакодинамикалық қасиеттері | Терапевтік қолдану | Құрылым |
|---|---|---|---|---|---|---|
| Варениклинді тартрат | Шампикс, Шантикс | 7,8,9,10-тетрагидро-6,10-метано-6Н-пиразино [2,3-с] [3] бензазепин[25] | Қабыршақпен қапталған планшет | Никотиндік ацетилхолин рецепторының ішінара агонисті, α кіші түрі4β2[26] | Темекіге тәуелділікті емдеу[26] |  |
| Галантамин гидробромиді | Реминил, Нивалин, Разадине және Разадин Э.Р. | 4а, 5,9,10,11,12-гексахидро-3-метокси-11-метил-6Н-бензофуро [3а, 3,2-эф] [2] -бензазепин-6-ол[27] | Тұрақты босатылатын капсула, қабықпен қапталған таблетка, ішілетін ерітінді | Холинэстераза ингибиторы және никотинді ацетилхолин рецепторының бәсекеге қабілетсіз агонисті[3] | Альцгеймер ауруы тудырған деменцияны емдеу[28] | 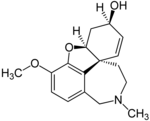 |
| Никотин | Никоретта, Nicotinell, Niquitin, Boots NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3 - [(2S) -1-метилпирролидин-2-ыл] пиридин | Трансдермальді патч, сағыз, ингалятор, мұрынға арналған спрей, пастилка, микротабон және темекіде табиғи түрде кездеседі | Никотиндік рецептордың агонисті,[29] екеуі де Ганглион типі және α4β2[30] | Темекіге тәуелділікті емдеу[31] | 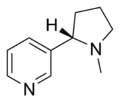 |
| Карбахол | Миостат | 2 - [(аминокарбонил) окси] -N, N, N-триметилетанаминий | Көзішілік ерітінді | Холинергиялық агонист[32] | Глаукоманы емдеу | 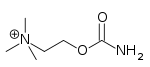 |
| Суксаметоний хлориді (Сукцинилхолин хлориді) | Анектин, хельсиин кукицин | 2,2 '- [(1,4-диоксобутан-1,4-диил) бис (окси)] бис (N, N, N-триметилетанаминий) | Көктамыр ішіне немесе бұлшықет ішіне енгізу | Деполяризациялаушы жүйке-бұлшықет бұғаттаушы агент[33] | Қысқа әсер ететін бұлшық ет босаңсытқыш[34] | |
| Эпибатидин | Тізімде жоқ | 2- (6-хлоропиридин-3-ыл) -7-азабицикло [2.2.1] гептан | Тізімде жоқ | Никотиндік ацетилхолин рецепторының агонисті[35] | Препарат ретінде қолданылмайды | 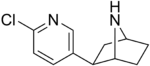 |
Клиникалық қолдану шектеулі болса да, басқа никотиндік агонистерге мыналар жатады:
- лобелин, агонист Ганглионды типтегі никотинді рецепторлар әсер етеді сенсорлық жүйке терминалдары[30]
- эпибатидин, агонист Ганглион типі, α4β2 және α7 рецепторлар[30]
- декаметоний себептері деполяризация блогы қосулы бұлшықет түрі рецепторлар, сексаметонияға ұқсас[30]
Никотиндік және мускариндік белсенділікке қарсы
| Холинергиялық агонистерді салыстыру[36] | ||||
|---|---|---|---|---|
| Зат | Рецепторлардың ерекшелігі | Гидролиз ацетилхолинэстераза | Түсініктемелер | |
| Мускаринді | Никотин | |||
| Холин | +++ | +++ | ++ | Маңызды қоректік зат |
| Ацетилхолин | +++ | +++ | +++ | Эндогенді лиганд |
| Карбахол | ++ | +++ | - | Емдеуде қолданылады глаукома |
| Метахолин | +++ | + | ++ | |
| Бетанехол | +++ | - | - | Қуықта және қолданылады асқазан-ішек гипотониясы. |
| Мускарин | +++ | - | - | Табиғи алкалоид белгілі бір саңырауқұлақтарда кездеседі. Саңырауқұлақтардан уланудың себебі |
| Никотин | - | +++ | - | Табылған табиғи алкалоид темекі зауыты. |
| Пилокарпин | ++ | - | - | Глаукома кезінде қолданылады |
| Оксотреморин | ++ | - | - | |
Ағымдағы күй
Қазіргі кезде никотинді рецепторлардың агонистік зерттеулері және дәрілік заттарды жобалау көптеген аурулар мен ОЖЖ бұзылыстарын емдеуге бағытталған.
Targacept-те есірткіге арналған үш кандидат бар клиникалық зерттеулер; Қазіргі уақытта II фазалық клиникалық сынақтарда тұрған ADHD үшін AZD3480 (TC-1734), Альцгеймер ауруы бойынша AZD1446 (TC-6683) AstraZeneca және TC-5619 үшін когнитивті дисфункциялар шизофрения кезінде.
Серіктесімен бірге есте сақтайтын фармацевтика Рош бір есірткіге үміткер бар, MEM 3454 (RG3487), ішінара агонисті никотиндік α7 рецепторы, Альцгеймер ауруы үшін.[37][38]
Эбботт зертханаларында NeuroSearch серіктестігімен клиникалық зерттеулерде екі есірткіге үміткер бар, ABT-894, ADHD және үшін селективті α4β2 никотинді рецепторлық агонист ABT-560, 2006 жылы Эбботт когнитивті дисфункцияларға жаңа дамуға үміткер ретінде таңдаған нейрондық никотинді рецепторлық модулятор.[39]
EnVivo фармацевтикасында клиникалық зерттеулерде бір дәрі-дәрмектерге үміткер бар, EVP-6124, Альцгеймер ауруы мен шизофрения үшін селективті α7 никотинді рецепторлы агонист және бір кейінгі қосылыс EVP-4473, ол сәтті аяқталды клиникаға дейінгі даму.[40]
Сондай-ақ қараңыз
- Мускариндік ацетилхолинді рецептор
- Мускариндік агонист
- Мускариндік антагонист
- Никотиндік ацетилхолин рецепторы
- Никотиндік антагонист
- Парасимпатомиметикалық препарат
Әдебиеттер тізімі
- ^ Хеннингфилд, Джек Е; Зеллер, Митч (2006), «Никотинді психофармакологияның АҚШ-қа қосқан үлесі және дүниежүзілік темекіні реттеу: артқа қарау және алға ұмтылу», Психофармакология, 184 (3–4): 286–291, дои:10.1007 / s00213-006-0308-4, PMID 16463054
- ^ а б Харутунян, Вахрам; Барнс, Эдуард; Дэвис, К.Л. (1985), «егеуқұйрықтардағы есте сақтаудың холинергиялық модуляциясы», Психофармакология, 87 (3): 266–271, дои:10.1007 / BF00432705, PMID 3001803
- ^ а б c г. e Буккафуско, Дж. Дж. (2004), «Нейрондық никотинді рецепторлардың кіші түрлері: терапевтік мақсатты анықтау» (PDF), Молекулалық араласу, 4 (5): 285–295, дои:10.1124 / мил.4.5.8, PMID 15471911
- ^ Буккафуско, Дж. Дж .; Джексон, В. Дж .; Терри кіші, AV; Марш, КС; Декер, МВт; Arneric, SP (1995), «ABT-418-ден кейінгі маймылдардың үлгіге сәйкестендіру бойынша кешіктірілген тапсырманы орындауын жақсарту: жадыны жақсартуға арналған холинергиялық арнаны жаңартушы», Психофармакология, 120 (3): 256–266, дои:10.1007 / BF02311172, PMID 8524972
- ^ Людвиг, Дж .; Höffle-Maas, A. (2010), «α-да галантамин байланыстыратын учаскенің бағытталған мутагенезі бойынша оқшаулау.7 никотиндік ацетилхолин рецепторларының жасушадан тыс домені », Рецепторлар мен сигналдарды беру журналы, 30 (6): 469–483, дои:10.3109/10799893.2010.505239, PMID 21062106
- ^ Лю, Чжаопин; Чжан, Дж; Берг, Дарвин К. (2007), «Эндогендік никотиндік сигналдың нейрондық дамуды басқарудағы рөлі», Биохимиялық фармакология, 74 (8): 1112–1119, дои:10.1016 / j.bcp.2007.05.022, PMC 2116993, PMID 17603025
- ^ а б Готти, С .; Клементи, Ф. (2004), «Нейрондық никотинді рецепторлар: құрылымнан патологияға дейін», Нейробиологиядағы прогресс, 74 (6): 363–396, дои:10.1016 / j.pneurobio.2004.09.006, PMID 15649582
- ^ а б c Патерсон, Дэвид; Нордберг, Агнета (2000), «Адам миындағы нейрондық никотиндік рецепторлар», Нейробиологиядағы прогресс, 61 (1): 75–111, дои:10.1016 / s0301-0082 (99) 00045-3, PMID 10759066
- ^ Сала, Ф .; Нистри, А .; Криадо, М. (2008), «Бүйрек үсті хромаффин жасушаларының никотиндік ацетилхолинді рецепторлары», Acta Physiologica, 192 (2): 203–212, дои:10.1111 / j.1748-1716.2007.01804.x, PMID 18005395[өлі сілтеме ]
- ^ а б c Итиер, Валери; Бертран, Даниэль (2001), «Нейрондық никотинді рецепторлар: белок құрылымынан функцияға дейін», FEBS хаттары, 504 (3): 118–125, дои:10.1016 / S0014-5793 (01) 02702-8, PMID 11532443
- ^ а б Lindstrom, JM (2003), «Бұлшықет пен нервтердің ацетилхолиндік рецепторлары», Нью-Йорк Ғылым академиясының жылнамалары, 998: 41–52, дои:10.1196 / жылнамалар. 1254.007, PMID 14592862[өлі сілтеме ]
- ^ Михайлеску, Стефан; Друкер-Колин, Рене (2000), «Никотин, мидың никотиндік рецепторлары және жүйке-психикалық бұзылыстар», Медициналық зерттеулер мұрағаты, 31 (2): 131–144, дои:10.1016 / S0188-4409 (99) 00087-9, PMID 10880717
- ^ Arias, Hugo R. (1997), «Никотиндік ацетилхолиндік рецептордағы лигандтың байланысатын жерлерінің топологиясы», Миды зерттеуге арналған шолулар, 25 (2): 133–191, дои:10.1016 / S0165-0173 (97) 00020-9, PMID 9403137
- ^ а б c г. Хайдар, Саймон Н .; Джирон, Чиара; Беттинетти, Лаура; Ботмэн, Хендрик; Комерия, Томас А .; Данлоп, Джон; Ла-Роза, Сальваторе; Мико, Иоланда; Полластрини, Мартина; Куинн, Джоанна; Ронкарати, Ренца; Скали, Карла; Валачки, Мишела; Варроне, Маурицио; Заналеттти, Риккардо (2009), «SEN12333 / WAY-317538: SAR және биологиялық бағалау: альфа 7 никотиндік ацетилхолин рецепторларының агонисті», Биоорганикалық және дәрілік химия, 17 (14): 5247–5258, дои:10.1016 / j.bmc.2009.05.040, PMID 19515567
- ^ Брунтон, Лоренс Л .; Лазо, Джон С .; Паркер, Кит Л., редакция. (2006), Гудман және Гилманның терапевттің фармакологиялық негіздері (11 басылым), McGRAW HILL, ISBN 978-0-07-142280-2
- ^ Унвин, Найджел (2004), «Никотиндік ацетилхолин рецепторының 4 A ° рұқсаттағы тазартылған құрылымы», Молекулалық биология журналы, 346 (4): 967–989, дои:10.1016 / j.jmb.2004.12.031, PMID 15701510
- ^ Кассельдер, Брюс К.; Бермудес, Изабель; Даджас, Федерико; Абин-Карриквири, Дж. Андрес; Wonnacott, Susan (2005), «Лиганд дизайнынан терапевтік тиімділікке дейін: никотинді рецепторларды зерттеу проблемасы», Бүгінде есірткіні табу, 10 (23–24): 1657–1665, дои:10.1016 / S1359-6446 (05) 03665-2, hdl:10533/176659, PMID 16376826
- ^ Готти, С .; Форнасари, Д .; Клементи, Ф. (1997), «Адамның нейрондық никотин рецепторлары», Нейробиологиядағы прогресс, 53 (2): 199–237, дои:10.1016 / S0301-0082 (97) 00034-8, PMID 9364611
- ^ Тондера, Жанне Э .; Олесена, Пребен Х .; Хансена, Джон Бондо; Бегтрупб, Микаэль; Petterssona, Ingrid (2001), «жақсартылған никотиндік фармакофор және орталық никотиндік ацетилхолин рецепторларында әрекет ететін никотиндік агонистерге арналған стереоселективті CoMFA-модель» [3H] -N-метилкарбамилхолин «, Компьютерлік молекулярлық дизайн журналы, 15 (3): 247–258, Бибкод:2001JCAMD..15..247T, дои:10.1023 / A: 1008140021426, PMID 11289078
- ^ Купер, Джулия С .; Гутброд, Оливер; Витцеманн, Вейт; Метфессел, Кристоф (1996), «Ксенопус ооциттерінде көрсетілген ұрықтың егеуқұйрық бұлшық еттерінен никотиндік ацетилхолин рецепторының фармакологиясы», Еуропалық фармакология журналы, 309 (3): 287–298, дои:10.1016/0014-2999(96)00294-4, PMID 8874153
- ^ Картер, Крис Р.Дж .; Као, Лирен; Кавай, Хидеки; Смит, Питер А .; Драйден, Уильям Ф .; Рафтери, Майкл А .; Данн, Сюзан МЖ (2007), «Торпедо никотиндік ацетилхолин рецепторымен екі қабатты лигандтардың өзара әрекеттесуінің тізбектегі тәуелділігі», Биохимиялық фармакология, 73 (3): 417–426, дои:10.1016 / j.bcp.2006.10.011, PMID 17118342
- ^ Хартон, Ив; Гийонно, Клод .; Локхарт, Брайан; Лестагеб, Пьер; Голдстеина, Соло (2008), «Жаңа никотинді лигандтардың дайындық және жақындық профилі», Биоорганикалық және дәрілік химия хаттары, 18 (6): 2188–2193, дои:10.1016 / j.bmcl.2007.12.075, PMID 18262785
- ^ Уокер, Даниэл П .; Вишка, Донн Г .; Пиотровский, Дэвид В .; Цзя, Шаоцзюань; Рейц, Стивен С .; Йейтс, Карен М .; Майерс, Джейсон К .; Ветман, Татьяна Н .; Марголис, Брэндон Дж.; Джейкобсен, Э. Джон; Аккер, Брэд А .; Гроппи, Винсент Е .; Вольф, Марк Л .; Торнбург, Брюс А .; Тинхолт, Паула М .; Кортес-Бургос, Луз А .; Уолтерс, Родни Р .; Хестер, Мэттью Р .; Сиест, Эрик П .; Долак, Лестер А .; Хан, Фузен; Олсон, Барбара А .; Фицджералд, Лаура; Статон, Брайан А .; Рауб, Томас Дж .; Хажос, Михалы; Гофман, Уильям Э .; Ли, Кай С .; Хигдон, Николь Р .; т.б. (2006), «Дизайн, синтез, құрылым - белсенділік және in vivo a7 никотиндік ацетилхолинді рецептор агонистері ретіндегі азабициклді ариламидтердің белсенділігі », Биоорганикалық және дәрілік химия, 14 (24): 8219–8248, дои:10.1016 / j.bmc.2006.09.019, PMID 17011782
- ^ http://www.envivopharma.com - Nicotinic Alpha7 ацетилхолинді рецепторлардың агонистік бағдарламасы Мұрағатталды 2010-01-07 сағ Wayback Machine
- ^ а б Роллема, Х .; Палаталар, Л.К .; Коу, Дж .; Глоуа, Дж .; Херст, Р.С .; Лебел, Л.А. Лу, Ю .; Мансбах, Р.С .; Мэтер, Р.Дж .; Роветти, СС; Құмдар, С.Б .; Шеффер, Э .; Шульц, Д.В .; Тангли III, Ф.Д .; Уильямс, К.Е. (2007), «α фармакологиялық профилі4β2 никотиндік ацетилхолин рецепторлары ішінара агонистік варениклин, темекіні тастауға тиімді құрал », Нейрофармакология, 52 (3): 985–994, дои:10.1016 / j.neuropharm.2006.10.016, PMID 17157884
- ^ а б «CHAMPIX 0,5 мг пленкамен қапталған таблеткалар; CHAMPIX 1 мг пленкамен қапталған таблеткалар - өнім сипаттамаларының қысқаша сипаттамасы (SmPC) - (eMC)». emc.medicines.org.uk. Архивтелген түпнұсқа 2012-12-24.
- ^ Гринблатт, Х.М .; Кригер, Г .; Льюис Т .; Силман, Мен .; Суссман, Дж.Л (1999), «2,3 ангстром қарсылығындағы галантаминмен (-) - комплекстелген ацетилхолинэстеразаның құрылымы», FEBS хаттары, 463 (3): 321–326, дои:10.1016 / S0014-5793 (99) 01637-3, PMID 10606746
- ^ «Реминил XL 8мг, 16мг және 24мг ұзаққа созылатын босату капсулалары - өнім сипаттамаларының қысқаша мазмұны (SmPC) - (eMC)». emc.medicines.org.uk. Архивтелген түпнұсқа 2012-12-24.
- ^ Дани, Джон А .; Биаси, Мариелла Де (2001), «Никотинге тәуелділіктің жасушалық механизмдері», Фармакология Биохимия және өзін-өзі ұстау, 70 (4): 439–446, дои:10.1016 / S0091-3057 (01) 00652-9, PMID 11796143
- ^ а б c г. Rang, H. P. (2003), Фармакология, Эдинбург: Черчилл Ливингстон, ISBN 978-0-443-07145-4 149 бет
- ^ XI, Чжэн-сион; Спиллер, Криста; Гарднер, Элиот Л. (2009), «Никотинге тәуелділікті емдеу үшін дәрі-дәрмектерді әзірлеу», Acta Pharmacol Sin, 30 (6): 723–739, дои:10.1038 / aps.2009.46, PMC 3713229, PMID 19434058, ProQuest 213027402
- ^ http://www.accessdata.fda.gov/drugsatfda_docs/label/2004/16968s022lbl.pdf
- ^ Туба, Золтан; Махо, Сандор; Визи, Э. Сильвестр (2002), «Нейромускулалық бұғаттау агенттерінің синтезі және құрылым-белсенділік байланыстары», Қазіргі дәрілік химия, 9 (16): 1507–1536, дои:10.2174/0929867023369466, PMID 12171561, ProQuest 215095660
- ^ «Анектидік инъекция - өнім сипаттамаларының қысқаша мазмұны (SmPC) - (eMC)». emc.medicines.org.uk. Архивтелген түпнұсқа 2012-12-24.
- ^ Кэрролл, Ф. Айви (2004), «Эпибатидин құрылым-белсенділік қатынастары», Биоорганикалық және дәрілік химия хаттары, 14 (8): 1889–1896, дои:10.1016 / j.bmcl.2004.02.007, PMID 15050621
- ^ Егер басқа өрістерде көрсетілмесе, онда сілтеме: 10-3-кесте: Род гүлі; Хэмфри П. Ранг; Морин М. Дейл; Риттер, Джеймс М. (2007), Рэндж & Дейлдің фармакологиясы, Эдинбург: Черчилл Ливингстон, ISBN 978-0-443-06911-6
- ^ «Мұрағатталған көшірме». Архивтелген түпнұсқа 2009-12-25. Алынған 2009-12-21.CS1 maint: тақырып ретінде мұрағатталған көшірме (сілтеме)
- ^ «Есте сақтайтын фармацевтика шизофрениямен байланысты когнитивті бұзылыстағы MEM 3454-ті зерттеудің 2-кезеңіне жазылу мақсатына жетеді».
- ^ http://www.neurosearch.dk/Default.aspx?ID=30
- ^ «Мұрағатталған көшірме». Архивтелген түпнұсқа 2009-08-06. Алынған 2009-12-21.CS1 maint: тақырып ретінде мұрағатталған көшірме (сілтеме)
Сыртқы сілтемелер
![]() Қатысты медиа Никотиндік агонистер Wikimedia Commons сайтында
Қатысты медиа Никотиндік агонистер Wikimedia Commons сайтында
- никотиникалық + агонистер АҚШ ұлттық медицина кітапханасында Медициналық тақырып айдарлары (MeSH)
- MeSH агенттерінің тізімі 82018722
