Фармакокинетика - Википедия - Pharmacokinetics
Фармакокинетикасы (бастап.) Ежелгі грек фармакон «есірткі» және кинетикос «қозғалу, қозғалысқа келтіру»; қараңыз химиялық кинетика ), кейде ретінде қысқартылған PK, болып табылады фармакология тірі организмге берілетін заттардың тағдырын анықтауға арналған. Қызығушылық тудыратын заттар кез-келген химиялық заттарды қамтиды ксенобиотикалық сияқты: фармацевтикалық препараттар, пестицидтер, тағамдық қоспалар, косметика Химиялық талдауға тырысады метаболизм және химиялық затты тағайындау сәтінен бастап оны толығымен енгізгенге дейін білу денеден шығарылды. Фармакокинетика - бұл организмнің есірткіге қалай әсер ететінін зерттейтін ғылым фармакодинамика (PD) - бұл препараттың ағзаға қалай әсер ететінін зерттейтін ғылым. Екеуі де әсер етеді мөлшерлеу, пайда, және жағымсыз әсерлер, көрсетілгендей PK / PD модельдері.
- Ағзаның дәрілік заттарды қабылдау процесі, олар өтетін биотрансформация, дәрілік заттардың таралуы және олардың метаболиттер ұлпаларда және белгілі бір уақыт аралығында организмнен дәрілерді және олардың метаболиттерін шығарып тастау.
- Осындай байланысты процестерді зерттеу[1]
Шолу
Фармакокинетика организмге сіңірілу және таралу тетіктері арқылы енгізілгеннен кейін белгілі бір ксенобиотикке / химиялық затқа қалай әсер ететінін, сондай-ақ организмдегі заттың метаболикалық өзгеруін сипаттайды (мысалы, метаболизм жолымен) ферменттер сияқты цитохром P450 немесе глюкуронозилтрансфераза ферменттер), және әсерлері мен шығарылу жолдары метаболиттер препарат.[2] Химиялық заттардың фармакокинетикалық қасиеттеріне қолдану тәсілі мен енгізілген препараттың дозасы әсер етеді. Бұл сіңіру жылдамдығына әсер етуі мүмкін.[3]
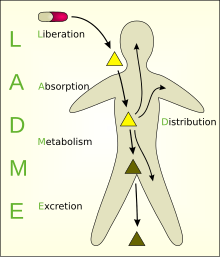
Организм мен химиялық заттың өзара әрекеттесуінде болатын көптеген процестердің тұжырымдамасын жеңілдетуге арналған модельдер жасалды. Соның бірі көп бөлімді модель, шындыққа ең жиі қолданылатын жақындату болып табылады; дегенмен, осы модельдеу тәсілімен параметрлерді қосудың күрделілігі дегенді білдіреді біркомпьютерлік модельдер және бәрінен бұрын екі бөлімше моделі ең жиі қолданылады. Модельге бөлінетін әртүрлі бөліктер, әдетте, деп аталады ADME схемасы (егер босату сіңіруден бөлек қадам ретінде енгізілсе, LADME деп те аталады):
- Lтеңдеу - есірткіні шығару процесі фармацевтикалық формула.[4][5] Сондай-ақ қараңыз IVIVC.
- Aбсорбция - заттың қан айналымына түсу процесі.
- Д.бөлу - заттардың ағзаның сұйықтықтары мен тіндеріне таралуы немесе таралуы.
- Мэтаболизм (немесе биотрансформация, немесе инактивация) - ағзаның бөгде заттың бар екендігін мойындауы және ата-аналық қосылыстардың еншілес метаболиттерге айналуы.
- Excretion - заттарды организмнен шығару. Сирек жағдайларда, кейбіреулері есірткілер қайтымсыз жинақталады дене ұлпасы.[дәйексөз қажет ]
Сондай-ақ метаболизм мен экскрецияның екі фазасын элиминация тақырыбы бойынша біріктіруге болады.Осы бөлек фазаларды зерттеу процестің динамикасын түсіну үшін негізгі ұғымдарды қолдануды және манипуляцияны қамтиды. Осы себепті, толық түсіну үшін кинетика есірткі туралы бірқатар факторлар туралы егжей-тегжейлі білу қажет, мысалы: әсер ететін заттардың қасиеттері қосалқы заттар, сәйкес сипаттамалары биологиялық мембраналар және заттардың оларды кесіп өту тәсілі немесе сипаттамалары ферменттік реакциялар есірткіні инактивациялайтын.
Барлық осы ұғымдар арқылы ұсынылуы мүмкін математикалық формулалар сәйкес келетіні бар графикалық бейнелеу. Осы модельдерді пайдалану а сипаттамаларын түсінуге мүмкіндік береді молекула, сондай-ақ белгілі бір есірткінің кейбір негізгі сипаттамаларына қатысты ақпаратты қалай ұстайтындығы, мысалы қышқылдың диссоциациялану константасы (pKa), биожетімділігі және ерігіштік, сіңіру қабілеті және организмде таралуы.
Препараттың модельдік нәтижелерін өнеркәсіпте қолдануға болады (мысалы, есептеу кезінде) биоэквиваленттілік жалпы дәрілік заттарды жобалау кезінде) немесе фармакокинетикалық тұжырымдамаларды клиникалық қолдану кезінде. Клиникалық фармакокинетика дәрі-дәрмектерді денсаулық сақтау саласындағы мамандарға тиімді және тиімді қолдану бойынша көптеген нұсқаулықтарды ұсынады ветеринария.
Көрсеткіштер
Төменде ең көп өлшенетін фармакокинетикалық көрсеткіштер:[6] Кестедегі дозаның бірліктері көрсетілген моль (моль) және молярлық (М). Кестенің метрикаларын массаның бірліктерімен емес, орнына өрнектеу үшін Заттың мөлшері, жай «mol» -ді «g» -ге, «M» -ді «g / dm3» -ке ауыстырыңыз. Сол сияқты, кестедегі басқа бірліктер баламалы бірліктермен көрсетілуі мүмкін өлшем масштабтау арқылы.
| Сипаттамалық | Сипаттама | Таңба | Бірлік | Формула | Жұмыс мысалы мәні |
|---|---|---|---|---|---|
| Доза | Препаратты енгізу мөлшері. | Дизайн параметрі | 500 ммоль | ||
| Дозалау аралығы | Препарат дозасын енгізу арасындағы уақыт. | Дизайн параметрі | 24 сағ | ||
| Cмакс | Препаратты қабылдағаннан кейін оның плазмадағы ең жоғары концентрациясы. | Тікелей өлшеу | 60,9 ммоль / л | ||
| тмакс | C жету уақытымакс. | Тікелей өлшеу | 3,9 сағ | ||
| Cмин | Ең төменгі (науа ) препарат келесі дозаны енгізгенге дейін жететін концентрация. | Тікелей өлшеу | 27,7 ммоль / л | ||
| Тарату көлемі | Препарат бөлінетін айқын көлем (яғни плазмадағы дәрілік концентрацияның организмдегі дәрілік зат мөлшеріне қатысты параметр). | 6,0 л | |||
| Шоғырландыру | Берілген көлемдегі препараттың мөлшері плазма. | 83,3 ммоль / л | |||
| Сіңірудің жартылай шығарылу кезеңі | Препарат концентрациясының ішу арқылы және басқа қан тамырларынан тыс жолдар үшін бастапқы мәнінен екі есе артуына қажет уақыт.[дәйексөз қажет ] | 1,0 сағ | |||
| Сіңіру жылдамдығы тұрақты | Ауыз қуысы арқылы және басқа қан тамырларынан тыс жолдармен организмге препараттың түсу жылдамдығы. | 0.693 −1 | |||
| Өмірді жартылай жою | Препараттың концентрациясы оның бастапқы мәнінің жартысына жетуіне қажет уақыт. | 12 сағ | |||
| Жою жылдамдығы тұрақты | Дәрі-дәрмектің ағзадан шығарылу жылдамдығы. | 0,0578 сағ−1 | |||
| Тұндыру жылдамдығы | Инфузияның жылдамдығы теңгерімді жою үшін қажет. | 50 ммоль / сағ | |||
| Қисық астындағы аймақ | The ажырамас концентрация-уақыт қисығының (бір дозадан кейін немесе тұрақты күйде). | 1,320 ммоль / л · сағ | |||
| Тазарту | Бірлік уақытында препараттан тазартылған плазма көлемі. | 0,38 л / сағ | |||
| Биожетімділігі | Препараттың жүйелік қол жетімді фракциясы. | Бірліксіз | 0.8 | ||
| Тербеліс | Тұрақты күйде бір мөлшерлеу аралығы шегінде ең жоғары деңгейдегі тербеліс. |
| 41.8% |
Фармакокинетикада, тұрақты мемлекет есірткіні жалпы қабылдау әділетті болатын жағдайды білдіреді динамикалық тепе-теңдік оны жоюмен. Іс жүзінде, тұрақты күйге тұрақты мөлшерде қабылдағаннан кейін препараттың жартылай шығарылу кезеңінен 3-тен 5 есеге дейінгі уақыт басталған кезде жетеді деп есептеледі.
Фармакокинетикалық модельдер
Бұл мақала Уикипедияға сәйкес қайта құру қажет болуы мүмкін орналасу нұсқаулары. (Сәуір 2019) (Бұл шаблон хабарламасын қалай және қашан жою керектігін біліп алыңыз) |

Фармакокинетикалық модельдеу компартенттік емес немесе жүзеге асырылады бөлімдік әдістер. Компартиралық емес әдістер есірткінің әсерін бағалау арқылы бағалайды қисық астындағы аймақ концентрация-уақыт графигі. Купеционалды әдістер кинетикалық модельдер көмегімен концентрация-уақыт графигін бағалайды. Компартиралық емес әдістер көбінесе жан-жақты болып келеді, өйткені олар қандай-да бір нақты компартенттік модельді қабылдамайды және биоэквиваленттілікті зерттеу үшін қолайлы нәтижелер береді. Дәрілік зат организмде болатын трансформациялардың соңғы нәтижелері және осы тағдырды анықтайтын ережелер санға байланысты өзара байланысты факторлар. Фармакокинетиканы зерттеуді жеңілдету мақсатында бірқатар функционалды модельдер жасалды. Бұл модельдер организмді бірқатар бөлімдер ретінде қарастыруға негізделген. Ең қарапайым идея - ағзаны тек біртекті бөлім деп қарастыру. Бұл монокомпозициялық модель деп болжайды қан плазмасы препараттың концентрациясы - бұл басқа сұйықтықтардағы немесе тіндердегі препарат концентрациясының шынайы көрінісі және дәріні жою организмдегі препарат концентрациясына тікелей пропорционалды (бірінші ретті кинетика ).
Алайда бұл модельдер организмдегі нақты жағдайды әрқашан шынайы түрде көрсете бермейді. Мысалы, дене тіндерінің барлығында бірдей емес қанмен қамтамасыз ету, сондықтан препараттың таралуы қанмен жақсы қамтамасыз етілген басқаларға қарағанда бұл тіндерде баяу болады. Сонымен қатар, кейбір тіндер бар (мысалы ми тін) дәрілік заттардың таралуына нақты тосқауыл болып табылады, оларды дәрілік заттың сипаттамаларына байланысты азды-көпті жеңілдетуге болады. Егер тіндердің әр түрлі типтеріне қатысты осы салыстырмалы шарттар элиминация жылдамдығымен бірге қарастырылса, онда организм екі бөлімше сияқты әрекет етеді деп есептеуге болады: біз оны орталық бөлім қанмен дамыған органдар мен жүйелерден тұратын жылдамырақ таралатын; және а перифериялық бөлім төменгі қан ағымы бар мүшелерден тұрады. Басқа тіндер, мысалы ми, есірткінің кросс арқылы өту қабілетіне байланысты өзгермелі позицияны иелене алады тосқауыл бұл органды қанмен қамтамасыздандыратын.
Бұл екі бөлім моделі бөлімді жоюдың қайсысында орын алатындығына байланысты өзгереді. Ең көп таралған жағдай - орталық бөлімде элиминацияның орын алуы бауыр және бүйрек бұл қанмен жақсы қамтамасыз етілетін органдар. Алайда, кейбір жағдайларда элиминация перифериялық бөлімде немесе тіпті екеуінде де болуы мүмкін. Бұл екі бөлім моделінде үш вариация болуы мүмкін дегенді білдіруі мүмкін, олар әлі де барлық мүмкіндіктерді қамтымайды.[8]
Бұл модель есірткіні метаболиздеуге жауапты ферменттердің бір бөлігі қаныққан жағдайда немесе препараттың плазмалық концентрациясына тәуелсіз белсенді элиминация механизмі бар жағдайларда қолданылмауы мүмкін. Шынайы әлемде әрбір ұлпаның өзіндік таралу сипаттамалары болады және олардың ешқайсысы сызықтық болмайды. Егер біз дәрі-дәрмекті таңбаласақ тарату көлемі организм ішінде VdF және оның матадағы таралу көлемі VdТ біріншісі әр түрлі әсер ететін барлық тіндерді ескеретін теңдеумен сипатталады, яғни:
Бұл көп камералы модель жалпы қисық алу үшін күрделі теңдеулерді білдіретін бірқатар қисықтармен. Бірқатар компьютерлік бағдарламалар осы теңдеулерді салу үшін жасалған.[8] Бұл модель қаншалықты күрделі және дәл болғанымен, ол дәрі-дәрмектің әр түрлі таралу мәндерін алуға жұмсалған күш-жігерге қарамастан шындықты шынымен көрсете алмайды. Себебі үлестіру көлемі ұғымы - бұл шындықтың шынайы көрінісі болып табылмайтын салыстырмалы ұғым. Үлгіні таңдау, ендеше, қайсысы қолданылатын препарат үшін ең аз қателік шегін ұсынатындығына байланысты.

Ведомстволық емес талдау
Компактивті емес анализ жалпы есірткі әсерін бағалауға өте тәуелді. Есірткінің жалпы әсерін көбінесе қисық астындағы аудандар бойынша бағалайды (AUC) трапеция тәрізді ереже (сандық интеграция ) ең кең таралған әдіс. Ұзындығына тәуелділігіне байланысты х трапеция тәрізді ережеде ауданды бағалау қан / плазмадан сынамалар алу кестесіне өте тәуелді. Яғни, уақыт нүктелері жақындаған сайын трапециялар концентрация-уақыт қисығының нақты формасын көрсетеді. НКА анализін сәтті жүргізу үшін қол жетімді уақыт саны дәрі-дәрмекті дәл сипаттау үшін сіңіру, таралу және элиминация кезеңін қамту үшін жеткілікті болуы керек. AUC әсер ету өлшемдерінен тыс CMax (максималды концентрация), Tmax (максималды концентрациядағы уақыт), CL және Vd сияқты параметрлерді NCA әдістерін қолдану арқылы да хабарлауға болады.
Бөлімшелік талдау
Ведомстволық ПК анализі концентрация-уақыт қисығын сипаттау және болжау үшін кинетикалық модельдерді қолданады. PK бөлімшелік модельдері көбінесе басқа ғылыми пәндерде қолданылатын кинетикалық модельдерге ұқсас химиялық кинетика және термодинамика. Сыртқы бөлімдердің кейбір бөлімдерге қарағанда артықшылығы - кез-келген уақытта концентрацияны болжау мүмкіндігі. Кемшілігі - тиісті модельді жасау мен растаудың қиындығы. Қисық сызуға негізделген бөліксіз модельдеу бұл шектеулерге ұшырамайды. Қарапайым ПК бөлімдік моделі - бұл IV болюстің әкімшілігі және бірінші ретті жою. PK күрделі модельдері (деп аталады) ПБПК модельдер) физиологиялық ақпараттарды қолдануға және дамуды жеңілдетуге негізделген.
Бір камералы модель
Сызықтық фармакокинетика деп аталады, өйткені әртүрлі факторлар арасындағы байланыс графигі (доза, қан плазмасындағы концентрация, жою және т.б.) а береді түзу сызық немесе біреуіне жуықтау. Дәрілердің тиімді болуы үшін олар қан плазмасынан дененің басқа сұйықтықтары мен тіндеріне жылдам ауыса алуы керек.
Уақыт бойынша концентрацияның өзгеруін былай өрнектеуге болады
Көп бөлімді модельдер

Әр түрлі факторлар арасындағы сызықтық емес байланыс графигі а қисық; факторлар арасындағы байланысты қисық астындағы әр түрлі аудандардың өлшемдерін есептеу арқылы табуға болады. Қолданылған модельдер сызықтық емес фармакокинетика негізінен негізделген Михаэлис-Ментен кинетикасы.Сызықтық емес реакцияның факторларына мыналар жатады:
- Мультифазалық сіңіру: инъекцияға арналған дәрі-дәрмектер ішілік екі негізгі механизм арқылы плазмадан шығарылады: (1) дене тіндеріне таралу және (2) метаболизм + дәрілік заттардың шығарылуы. Нәтижесінде препараттың плазмалық концентрациясының төмендеуі екі фазалы сызба бойынша жүреді (суретті қараңыз).
 Плазмалық препараттың концентрациясы IV дозадан кейінгі уақытқа қарсы
Плазмалық препараттың концентрациясы IV дозадан кейінгі уақытқа қарсы- Альфа фазасы: плазмалық концентрациясының тез төмендеуінің бастапқы фазасы. Төмендеу бірінші кезекте дәрі-дәрмектің орталық бөлімнен (қан айналымынан) перифериялық бөліктерге (дене тіндеріне) таралуына байланысты. Бұл фаза орталық және перифериялық бөлімдер арасында есірткі концентрациясының жалған тепе-теңдігі орнатылған кезде аяқталады.
- Бета фаза: альфа фазасынан кейін плазмадағы концентрациясының біртіндеп төмендеу фазасы. Төмендеу, ең алдымен, есірткіні жоюға, яғни метаболизм мен экскрецияға байланысты.[9]
- Кейде қосымша фазалар (гамма, дельта және т.б.) көрінеді.[10]
- Препараттың сипаттамалары қан ағымы жоғары және төмен ұлпалардың арасындағы айырмашылықты анықтайды.
- Ферментативті қанықтылық: Элиминациясы биотрансформацияға байланысты болатын препараттың дозасы белгілі бір шектен жоғарылағанда, оның метаболизміне жауап беретін ферменттер қаныққан. Содан кейін препараттың плазмадағы концентрациясы пропорционалды емес жоғарылайды және оны жою тұрақты болмайды.
- Индукция немесе ферментативті тежелу: Кейбір дәрі-дәрмектер өздерінің метаболизмін тежеуге немесе ынталандыруға қабілетті, теріс немесе Жағымды пікір реакциялар. Қалай пайда болады флувоксамин, флуоксетин және фенитоин. Осы фармацевтикалық препараттардың үлкен дозаларын қабылдаған кезде метаболизденбеген препараттың плазмалық концентрациясы жоғарылайды және жартылай шығарылу кезеңі артады. Сондықтан дозаны немесе басқа емдеу параметрлерін жоғары дозалау қажет болған кезде түзету қажет.
- Бүйрек сонымен қатар плазмадағы концентрациядан тәуелсіз кейбір дәрілерді белсенді жою механизмдерін құра алады.
Демек, сызықтық емес болуы бүкіл фармакокинетикалық дәйектілікке әсер ететін себептерге байланысты болуы мүмкін: сіңіру, таралу, метаболизм және элиминация.
Биожетімділігі

Практикалық деңгейде препараттың биожетімділігі оның әсер ету орнына жеткен препараттың үлесі ретінде анықталуы мүмкін. Осы тұрғыдан алғанда ішілік есірткіні енгізу мүмкіндігінше биожетімділігін қамтамасыз етеді және бұл әдіс биожетімділігі 1 (немесе 100%) құрайды деп саналады. Жеткізудің басқа әдістерінің биожетімділігі көктамырішілік инъекциямен (абсолютті биожетімділігі) немесе белгілі бір зерттеудегі басқа жеткізу әдістерімен байланысты стандартты мәнмен (салыстырмалы биожетімділігі) салыстырылады.
Препараттың биожетімділігі анықталғаннан кейін, қан плазмасындағы қажетті деңгейге жету үшін оның дозасына енгізілетін өзгерістерді есептеуге болады. Биожетімділігі - бұл енгізілген дозаға әсер ететін әрбір жеке препарат үшін математикалық фактор. Қан плазмасындағы әсер етудің нақты потенциалы бар препараттың мөлшерін мына формула арқылы есептеуге болады:
қайда De болып табылады тиімді доза, B биожетімділігі және Да енгізілген доза.
Сондықтан, егер препараттың биожетімділігі 0,8 (немесе 80%) болса және оны 100 мг дозада енгізсе, теңдеу мынаны көрсетеді:
- De = 0,8 × 100 мг = 80 мг
Бұл енгізілген 100 мг қан плазмасындағы 80 мг концентрациясын білдіреді, ол фармацевтикалық әсер етуге қабілетті.
Бұл тұжырымдама әр препаратқа тән бірқатар факторларға байланысты, мысалы:[11]
- Фармацевтикалық форма
- Химиялық формасы
- Әкімшілік маршрут
- Тұрақтылық
- Метаболизм
Тиісті мақалаларында егжей-тегжейлі талқыланатын бұл тұжырымдамалар жалпы математикалық теңдеуді алу үшін математикалық санмен анықталып интеграциялануы мүмкін:
қайда Q бұл препараттың тазалығы.[11]
қайда - бұл препараттың енгізу жылдамдығы және сіңірілген препараттың қан айналым жүйесіне жету жылдамдығы.
Соңында Гендерсон-Хассельбалч теңдеуі және есірткіні білу (рН оның иондалған және иондалмаған молекулалары арасында тепе-теңдік болатын кезде), препараттың иондалмаған концентрациясын, демек, сіңірілуге жататын концентрацияны есептеуге болады:
Екі препараттың биожетімділігі бірдей болған кезде, олар биологиялық эквивалент немесе биоэквивалент деп аталады. Бұл тұжырымдама биоэквиваленттілік маңызды, өйткені ол қазіргі кезде авторизациялау кезінде өлшем ретінде қолданылады жалпы дәрілер көптеген елдерде.
LADME
Препарат организммен байланысқа түскеннен кейін бірқатар фазалар пайда болады, LADME аббревиатурасы арқылы сипатталады:
- Азат ету жеткізу жүйесінен белсенді зат,
- Сіңіру ағзаның белсенді затының,
- Тарату қан плазмасы және дененің әр түрлі тіндері арқылы,
- Метаболизм бұл ксенобиотикалық заттың инактивациясы және ақыр соңында
- Шығару немесе жою зат немесе оның метаболизмі өнімдері.
Кейбір оқулықтар алғашқы екі фазаны біріктіреді, өйткені препарат көбіне белсенді түрде енгізіледі, демек босатылу кезеңі жоқ. Басқаларына таралу, метаболизм және бөлінуді диспозициялық фазаға біріктіретін фаза жатады. Басқа авторлар есірткінің токсикологиялық аспектісін белгілі деп атайды ADME-токс немесе ADMET.
Фазалардың әрқайсысы препарат пен организм арасындағы физикалық-химиялық өзара әрекеттесуге ұшырайды, оны математикалық түрде көрсетуге болады. Сондықтан фармакокинетика математикалық теңдеулерге негізделген, бұл препараттың мінез-құлқын болжауға мүмкіндік береді және дәрі-дәрмектің қан плазмасындағы концентрациясы мен препарат қолданылғаннан кейінгі уақыт арасындағы қатынастарға үлкен мән береді.
Талдау
Биоаналитикалық әдістер
Биоаналитикалық әдістер шоғырлану-уақыт профилін құру үшін қажет. Дәрілік заттардың концентрациясын өлшеу үшін химиялық әдістер қолданылады биологиялық матрица, көбінесе плазма. Дұрыс биоаналитикалық әдістер таңдамалы және сезімтал болуы керек. Мысалға, микроскальды термофорез биологиялық матрица / сұйықтық дәрілік заттың мақсатына жақындығына қалай әсер ететінін анықтау үшін қолдануға болады.[12][13]
Масс-спектрометрия
Фармакокинетикасын жиі қолдана отырып зерттейді масс-спектрометрия матрицаның күрделі сипатына байланысты (көбінесе плазма немесе зәр) және төмен дозадан және ұзақ уақыт кезеңінен кейін концентрацияны байқау үшін жоғары сезімталдық қажет. Бұл қосымшада қолданылатын ең кең таралған аспаптар болып табылады LC-MS а үш квадруполды масс-спектрометр. Тандемді масс-спектрометрия әдетте қосымша спецификация үшін қолданылады. Стандартты қисықтар мен ішкі стандарттар үлгілерде әдетте бір фармацевтика мөлшерін анықтау үшін қолданылады. Үлгілер фармацевтикалық препаратты тағайындайтын, содан кейін метаболизденетін немесе организмнен тазартылған кезде әр түрлі уақытты білдіреді. Әкімшілікке дейін алынған бос үлгілер фонды анықтауда және осындай күрделі іріктеу матрицаларында мәліметтердің тұтастығын қамтамасыз етуде маңызды. Стандартты қисықтың сызықтығына көп көңіл бөлінеді; дегенмен оны пайдалану әдеттегідей қисық фитинг сияқты күрделі функцияларымен квадратика көптеген масс-спектрометрлердің реакциясы үлкен концентрация диапазонында сызықтық емес болғандықтан.[14][15][16]
Қазіргі уақытта өте жоғары сезімталдық масс-спектрометриясын қолдануға үлкен қызығушылық бар микродозирование перспективалы балама ретінде қарастырылатын зерттеулер жануарларға арналған эксперимент.[17] Соңғы зерттеулер көрсеткендей Екінші электроспрей ионизациясы (SESI-MS) жануарларды құрбандыққа шалудан бас тартудың артықшылығын ұсына отырып, есірткіні бақылауда қолдануға болады.[18]
Популяцияның фармакокинетикасы
Популяцияның фармакокинетикасы қызығушылық тудыратын препараттың клиникалық маңызды дозаларын алатын мақсатты пациент популяциясы болып табылатын адамдар арасындағы есірткі концентрациясының өзгергіштік көздері мен корреляциясын зерттеу болып табылады.[19][20][21] Дененің салмағы, экскреторлық және метаболикалық функциялар және басқа терапиялардың болуы сияқты кейбір пациенттердің демографиялық, патофизиологиялық және терапиялық ерекшеліктері доза-концентрация байланыстарын үнемі өзгерте алады және экспозициялардың өзгергіштігін түсіндіре алады. Мысалы, көбінесе бүйрек арқылы шығарылатын дәрілік заттардың тұрақты концентрациясы, әдетте, зардап шегетін науқастарда көп болады бүйрек жеткіліксіздігі бүйректері қалыпты жұмыс жасайтын науқастарға қарағанда, олардың мөлшері бірдей. Популяцияның фармакокинетикасы өлшенетін патофизиологиялық факторларды анықтауға және доза-концентрация байланысының өзгеруіне әкелетін өзгергіштік көздерін және осы өзгерістердің дәрежесін түсіндіруге тырысады, егер мұндай өзгерістер терапевтік индекске әсер ететін экспозициялардың клиникалық маңызды және маңызды ауысуларымен байланысты болса. , дозаны тиісті түрде өзгертуге болады.Популяциялық фармакокинетикалық модельдеудің артықшылығы оның сирек деректер жиынтығын талдау мүмкіндігі болып табылады (кейде бір пациентке шоғырланудың бір ғана өлшемі бар).
Клиникалық фармакокинетикасы
| Эпилепсияға қарсы дәрі-дәрмек | Кардиоактивті дәрі-дәрмек | Иммуносупрессор дәрі-дәрмек | Антибиотик дәрі-дәрмек |
|---|---|---|---|
| Бронходилататор дәрі-дәрмек | Цитостатикалық дәрі-дәрмек | Вирусқа қарсы (АИТВ) дәрі-дәрмектер | Коагуляция факторлары |
| + Эфавиренз |
Клиникалық фармакокинетика (популяциялық фармакокинетиканы клиникалық қолданудан туындайтын) - бұл дәрі-дәрмектің фармакокинетикасына және пациенттің тиесілі (немесе оған жатқызылуы мүмкін) популяцияның сипаттамаларына қатысты білімнің терапиялық жағдайына тікелей қолдану.
Мысал ретінде қолдануды қайта іске қосуға болады циклоспорин ретінде иммуносупрессор органдарды трансплантациялауды жеңілдету. Бастапқыда препараттың терапиялық қасиеттері көрсетілді, бірақ оның пайда болуына байланысты ол ешқашан қолданылмады нефроуыттылық бірқатар науқастарда.[22] Алайда, содан кейін пациенттердің плазматикалық концентрациясын (фармакокинетикалық бақылау) талдау арқылы пациенттің циклоспорин дозасын жекелендіруге болатындығы түсінілді. Бұл тәжірибе бұл препаратты қайтадан қолдануға мүмкіндік берді және көптеген органдарды трансплантациялауға мүмкіндік берді.
Клиникалық бақылау, әдетте, плазмадағы концентрациясын анықтау арқылы жүзеге асырылады, себебі бұл мәліметтер оңай және сенімді болып табылады. Препараттың плазмалық концентрациясын анықтаудың негізгі себептеріне мыналар жатады:[23]
- Тар терапевтік диапазон (токсикалық және терапевтік концентрация арасындағы айырмашылық)
- Жоғары уыттылық
- Өмірге қауіптілігі жоғары.
Экотоксикология
Бұл бөлім кеңейтуді қажет етеді. Сіз көмектесе аласыз оған қосу. (Сәуір 2019) |
Экотоксикология қоршаған ортаға зиянды заттардың табиғаты, әсері және өзара әрекеттесуін қарастыратын ғылым саласы.[24][25]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ Нордберг М, Даффус Дж, Темплтон ДМ (1 қаңтар 2004). «Токсикокинетикада қолданылатын терминдер сөздігі (2003 ж. IUPAC ұсыныстары)». Таза және қолданбалы химия. 76 (5): 1033–1082. дои:10.1351 / пак200476051033. S2CID 98275795.
- ^ Фармакокинетикасы. (2006). Жылы Мосбидің медицина, мейірбике ісі және денсаулық мамандықтары сөздігі. Филадельфия, Пенсильвания: Elsevier Health Sciences. 11 желтоқсан 2008 ж. Бастап алынды http://www.credoreference.com/entry/6686418
- ^ Найтс К, Брайант Б (2002). Денсаулық сақтау мамандарына арналған фармакология. Амстердам: Эльзевье. ISBN 0-7295-3664-5.
- ^ Koch HP, Ritschel WA (1986). «Азаттық». Synopsis der Biopharmazie und Pharmakokinetik (неміс тілінде). Ландсберг, Мюнхен: Экомед. 99–131 бет. ISBN 3-609-64970-4.
- ^ Руис-Гарсия А, Бермехо М, Мосс А, Касабо В.Г. (ақпан 2008). «Дәрілік заттарды табудағы фармакокинетика». Фармацевтикалық ғылымдар журналы. 97 (2): 654–90. дои:10.1002 / jps.21009. PMID 17630642.
- ^ AGAH жұмыс тобы Фармакокинетика (2004-02-16). «Терминдер, шартты белгілер, теңдеулер және жалпы фармакокинетикалық және фармакодинамикалық параметрлер мен кейбір статистикалық функцияларды түсіндіру» (PDF). Arbeitsgemeinschaft für Angewandte Humanpharmakologie (AGAH) (Адамның қолданбалы фармакология қауымдастығы). Архивтелген түпнұсқа (PDF) 2016-05-08. Алынған 2011-04-04.
- ^ Фармакокинетика Онлайн ресурсы Лозанна университеті Биология және медицина факультеті (ФБМ)
- ^ а б Мило Гибальди, Дональд Перриер. ФармакоцинетикаReverté 1982 беттер 1–10. ISBN 84-291-5535-X, 9788429155358
- ^ Gill SC, Moon-Mcdermott L, Hunt TL, Deresinski S, Blaschke T, Sandhaus RA (қыркүйек 1999). «І фаза липосомалық амикациннің (MiKasome) адам заттары фармакокинетикасы: дозаға тәуелділік және зәрді тазарту». Abstr Intersci Conf микробқа қарсы агенттер. 39: 33 (реферат № 1195).
- ^ Вайнер Д, Габриэлссон Дж (2000). «PK24 - Сызықтық емес кинетика - ағын II». Фармакокинетикалық / фармакодинамикалық деректерді талдау: түсініктері мен қолданылуы. Apotekarsocieteten. 527–36 бб. ISBN 91-86274-92-9.
- ^ а б Майкл Э. Винтер, Мэри Энн Кода-Кимпл, Ллойд Ю. Янг, Эмилио Пол Янгуас Farmacocinética clínica básica Ediciones Díaz de Santos, 1994 б. 8-14 ISBN 84-7978-147-5, 9788479781477 (испан тілінде)
- ^ Baaske P, Wienken CJ, Reineck P, Duhr S, Braun D (наурыз 2010). «Аптамер байланысының буферлік тәуелділігін сандық анықтауға арналған оптикалық термофорез». Angewandte Chemie. 49 (12): 2238–41. дои:10.1002 / anie.200903998. PMID 20186894. Түйіндеме – Phsyorg.com.
- ^ Wienken CJ, Baaske P, Rothbauer U, Braun D, Duhr S (қазан 2010). «Микроскальды термофорезді қолдана отырып биологиялық сұйықтықтардағы ақуыздармен байланысатын талдау». Табиғат байланысы. 1 (7): 100. Бибкод:2010NatCo ... 1..100W. дои:10.1038 / ncomms1093. PMID 20981028.
- ^ Hsieh Y, Korfmacher WA (маусым 2006). «Дәрілік зат алмасу және фармакокинетикалық скрининг үшін HPLC-MS / MS жүйелерін қолдану кезінде жылдамдық пен өнімділікті арттыру». Ағымдағы дәрілік зат алмасу. 7 (5): 479–89. дои:10.2174/138920006777697963. PMID 16787157.
- ^ Covey TR, Lee ED, Henion JD (қазан 1986). «Биологиялық үлгілердегі дәрілік заттарды анықтауға арналған жоғары жылдамдықты сұйық хроматография / тандемді масс-спектрометрия». Аналитикалық химия. 58 (12): 2453–60. дои:10.1021 / ac00125a022. PMID 3789400.
- ^ Covey TR, Crowther JB, Dewey EA, Henion JD (ақпан 1985). «Термоспрей сұйық хроматографиясы / биологиялық сұйықтықтардағы дәрілік заттар мен олардың метаболиттерін масс-спектрометриямен анықтау». Аналитикалық химия. 57 (2): 474–81. дои:10.1021 / ac50001a036. PMID 3977076.
- ^ Адамға арналған дәрілік заттар комитеті (CHMP) (желтоқсан 2009). «Адамның клиникалық сынақтарын жүргізу және фармацевтикаға маркетингтік рұқсат беру үшін клиникалық емес қауіпсіздікті зерттеу бойынша ICH нұсқаулығы M3 (R2)» (PDF). Еуропалық дәрі-дәрмек агенттігі, Адамзат үшін дәрі-дәрмектерді бағалау. EMA / CPMP / ICH / 286/1995. Алынған 4 мамыр 2013.
- ^ Ли, Сюэ; Мартинес-Лозано Синуес, Пабло; Даллман, Роберт; Бреги, Лукас; Холлмен, Майджа; Прулкс, Стивен; Браун, Стивен А .; Детмар, Майкл; Колер, Малкольм; Зеноби, Ренато (2015-06-26). «Тышқан тынысын нақты уақытта талдау арқылы анықталатын дәрі-дәрмек фармакокинетикасы». Angewandte Chemie International Edition. 54 (27): 7815–7818. дои:10.1002 / anie.201503312. hdl:20.500.11850/102558. PMID 26015026.
- ^ Шейнер Л.Б., Розенберг Б, Марате В.В. (қазан 1977). «Күнделікті клиникалық мәліметтерден фармакокинетикалық параметрлердің популяция сипаттамаларын бағалау». Фармакокинетика және биофармацевтика журналы. 5 (5): 445–79. дои:10.1007 / BF01061728. PMID 925881. S2CID 28622472.
- ^ Sheiner LB, Beal S, Rosenberg B, Marathe VV (қыркүйек 1979). «Жеке фармакокинетиканы болжау». Клиникалық фармакология және терапевтика. 26 (3): 294–305. дои:10.1002 / cpt1979263294. PMID 466923. S2CID 41194071.
- ^ Bonate PL (қазан 2005). «Популяциялық фармакокинетикалық фармакодинамикада оқылатын ұсыныстар». AAPS журналы. 7 (2): E363-73. дои:10.1208 / aapsj070237. PMC 2750974. PMID 16353916.
- ^ О'Валле, Ф .; Гарсия дель Мораль, Р .; Андуджар, М. (1995). «Mecanismos de nefrotoxicidad por ciclosporina A a nivel celular». Нефрология (Испанша). 15 1-қосымша.
- ^ Хоакин Эррера Карранца Farmacia clínica және Atención Farmacéutica нұсқаулығы (Испанша). Elsevier España жариялады, 2003; 159 бет. ISBN 84-8174-658-4
- ^ Джейгер Т, Альберт С, Преусс Т.Г., Ашауэр Р (сәуір 2011). «Тіршілік етудің жалпы бірыңғай шекті моделі - экотоксикологияның токсикокинетикалық-токсикодинамикалық негізі». Қоршаған орта туралы ғылым және технологиялар. 45 (7): 2529–40. Бибкод:2011 ENST ... 45.2529J. дои:10.1021 / es103092a. PMID 21366215.
- ^ Ашауэр Р. «Токсикокинетикалық-токсикодинамикалық модельдер - экотоксикология және модельдер». Швейцария су ғылымдары және технологиялар федералды институты. Архивтелген түпнұсқа 2012-04-05. Алынған 2011-12-03.
Сыртқы сілтемелер
Бұл мақала қолдану сыртқы сілтемелер Википедия ережелері мен нұсқаулықтарын сақтамауы мүмкін. (Мамыр 2016) (Бұл шаблон хабарламасын қалай және қашан жою керектігін біліп алыңыз) |
Бағдарламалық жасақтама
- Ведомстволық емес
- Тегін бағдарламалар: аю және PK үшін R
- Коммерциялық: MLAB, EquivTest, Кинетика, MATLAB / SimBiology, PKMP,Феникс / WinNonlin, PK шешімдері, RapidNCA.
- Купе негізделген
- Тегін бағдарламалар: АДАПТЫ, Бумер (GUI ), SBPKPD.org (жүйелік биологияға негізделген фармакокинетика және фармакодинамика), WinSAAM, PKfit R үшін, PharmaCalc және PharmaCalcCL, Java қосымшалары.
- Коммерциялық: Ималитика, Кинетика, MATLAB / SimBiology, Феникс / WinNonlin, PK шешімдері, PottersWheel, ProcessDB, SAAM II.
- Физиологиялық негізделген
- Тегін бағдарламалар: MCSim
- Коммерциялық: acslX, Cloe PK, GastroPlus, MATLAB / SimBiology, ПК-Сим, ProcessDB, Simcyp, Entelos PhysioLab Феникс / WinNonlin, ADME Workbench.
- ПҚ тұрғындары
- Тегін бағдарламалар: WinBUGS, ADAPT, S-ADAPT / SADAPT-TRAN, Boomer, PKBugs, Петрика R. үшін
- Коммерциялық: Kinetica, MATLAB / SimBiology, Моноликс, NONMEM, Феникс / NLME, ПопКинетика SAAM II үшін, USC * PACK, DoseMe-Rx, Navigator Workbench.
- Модельдеу
Жоғарыда келтірілген барлық модельге негізделген бағдарламалық жасақтама.
- Тегін бағдарламалар: КОПАСИ, Беркли Мадонна, MEGen.
Оқу орталықтары
Тереңдетілген оқытуды ұсынатын жоғары профильді ғаламдық орталықтарға Университеттер кіреді Буффало,Флорида, Гетеборг, Лейден, Отаго, Сан-Франциско, Пекин, Токио, Уппсала, Вашингтон, Манчестер, Монаш университеті және Шеффилд.[1]
- ^ Tucker GT (маусым 2012). «Фармакокинетиканың зерттеу басымдықтары». Британдық клиникалық фармакология журналы. 73 (6): 924–6. дои:10.1111 / j.1365-2125.2012.04238.x. PMC 3391520. PMID 22360418.











































![{displaystyle B_{A}={frac {[ABC]_{P}cdot D_{IV}}{[ABC]_{IV}cdot D_{P}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0349b27d143a975c5e5c3eeaf83b49e8c7a3318)
![{displaystyle {mathit {B}}_{R}={frac {[ABC]_{A}cdot { ext{dose}}_{B}}{[ABC]_{B}cdot { ext{dose}}_{A}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/634ea7e9316eeae72a9904dcaf1ccb2c43511aaf)





