Дихлор гептоксиді - Dichlorine heptoxide
 | |
 | |
| Атаулар | |
|---|---|
| IUPAC атауы Дихлор гептоксиді | |
| Басқа атаулар Хлор (VII) оксиді; Перхлорлы ангидрид; (Перхлорилокси) хлоран триоксиді | |
| Идентификаторлар | |
3D моделі (JSmol ) | |
| Чеби | |
| ChemSpider | |
PubChem CID | |
CompTox бақылау тақтасы (EPA) | |
| |
| |
| Қасиеттері | |
| Cl2O7 | |
| Молярлық масса | 182,901 г / моль |
| Сыртқы түрі | түссіз сұйықтық |
| Тығыздығы | 1,9 г / см3 |
| Еру нүктесі | -91,57 ° C (-132,83 ° F; 181,58 K) |
| Қайнау температурасы | 82 ° C (180 ° F; 355 K) |
| гидролиз түзіледі хлор қышқылы | |
| Қауіпті жағдайлар | |
| Негізгі қауіптер | тотықтырғыш, контактілі жарылғыш зат[1] |
| NFPA 704 (от алмас) | |
| Байланысты қосылыстар | |
Байланысты қосылыстар | Марганецті гептоксид |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
Дихлор гептоксиді болып табылады химиялық қосылыс бірге формула Cl2O7. Бұл хлор оксиді болып табылады ангидрид туралы хлор қышқылы. Ол сусыздандыру агентінің қатысуымен хлор қышқылын мұқият айдау арқылы өндіріледі фосфор октоксиді:[1]
- 2 HClO4 + P4O10 → Cl2O7 + H2P4O11
Хлор (VII) оксидін қоспадан тазартуға болады.
Ол сондай-ақ хлор мен қоспаларындағы жарықтандыру арқылы пайда болуы мүмкін озон.[2] Бұл баяу гидролиз оралу хлор қышқылы, бұл кезде қауіпті сусыз.
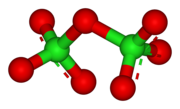
Құрылым
Cl2O7 бұл эндергоникалық молекула, яғни энергия тұрақтамай, құрамына кіретін элементтерге дейін ыдырайтын ішкі тұрақсыз:[3]
- 2 Cl2O7 → 2 Cl2 + 7 O2 (ΔH ° = –132 ккал / моль)
Cl2O7 118,6 ° бұрышпен Cl − O − Cl бұрышымен бүгіліп, С молекуласын береді2 симметрия. Cl − O терминалының арақашықтықтары 1,709 Å, ал Cl = O арақашықтықтары 1,405 Å.[1] Бұл қосылыста хлор формальды түрде болады тотығу дәрежесі Бұл молекуладағы байланыс айтарлықтай ковалентті болғанымен +7.
Химия
Дихлор гептоксиді біріншілік және екіншілікпен әрекеттеседі аминдер жылы төрт хлорлы көміртек хлорлы амидтерді алуға арналған ерітінді:[4]
- 2 RNH
2 + Cl
2O
7 → 2 RNHClO
3 + H
2O - 2 R
2NH + Cl
2O
7 → 2 R
2NClO
3 + H
2O
Ол сонымен бірге әрекет етеді алкендер алкил перхлораттарын беру. Мысалы, ол реакция жасайды пропен төрт хлорлы көміртегі ерітіндісінде изопропилхлорат және 1-хлор-2-пропилхлорат алу үшін.[5]
Дихлор гептоксиді - қатты қышқыл оксиді, ал ерітіндіде ол перхлор қышқылымен тепе-теңдік түзеді.
Қауіпсіздік
Бұл ең тұрақты хлор оксиді болғанымен, Cl2O7 бұл күшті тотықтырғыш, сондай-ақ жалынмен немесе механикалық соққымен немесе жанасу арқылы іске қосылатын жарылғыш зат йод.[6] Соған қарамастан, ол басқа хлор оксидтеріне қарағанда қатты тотықтырмайды және оған әсер етпейді күкірт, фосфор, немесе қағаз суық кезде.[1] Ол адам ағзасына элементар сияқты әсер етеді хлор, және сол сақтық шараларын қажет етеді.[7]
Әдебиеттер тізімі
- ^ а б c г. Холлеман, Арнольд Ф.; Wiberg, Egon (2001). Бейорганикалық химия. Мэри Иглсон аударған; Уильям Брюер. Сан-Диего: академиялық баспасөз. б. 464. ISBN 0-12-352651-5.
- ^ Бернс, А. С .; Ролефсон, Г.К. (1934). «Хлор мен озон қоспаларын жарықтандыруда хлор пенатоксидінің түзілуі». Американдық химия қоғамының журналы. 56 (5): 1250–1251. дои:10.1021 / ja01320a506.
- ^ Мартин, Ян М.Л (2006-10-12). «Хлор қышқылы, HClO түзілу жылуы4, және хлорлы ангидрид, Cl2O7. W1 және W2 теориясының шекараларын тексеру ». Молекулалық құрылым журналы: THEOCHEM. Модельдеу құрылымы және реактивтілігі: Бүкіләлемдік теориялық және есептеу химиктері қауымдастығының 7-үш жылдық конференциясы (WATOC 2005). 771 (1): 19–26. arXiv:физика / 0508076. дои:10.1016 / j.theochem.2006.03.035. ISSN 0166-1280.
- ^ Сақал, Д .; Баум, К. (1974). «Дихлор гептоксидінің аминдермен реакциясы». Американдық химия қоғамының журналы. 96 (10): 3237–3239. дои:10.1021 / ja00817a034.
- ^ Баум, К. (1976). «Дехлор гептоксидінің олефиндермен реакциясы». Органикалық химия журналы. 41 (9): 1663–1665. дои:10.1021 / jo00871a048.
- ^ Льюис, Роберт Алан (1998). Льюистің токсикология сөздігі. CRC Press. б.260. ISBN 1-56670-223-2.
- ^ Жанна Магер Стеллман, ред. (1998). «Галогендер және олардың қосылыстары». Еңбек қауіпсіздігі және энциклопедиясы (4-ші басылым). Халықаралық еңбек ұйымы. б.104.210. ISBN 92-2-109817-6.

