Уолш диаграммасы - Walsh diagram

Уолш диаграммалары, жиі шақырылады бұрыштық координаталық диаграммалар немесе корреляциялық диаграммалар, а-ның есептелген орбиталық байланыс энергиясының көрінісі молекула кішігірім молекулалардың геометриялары туралы жылдам болжамдар жасау үшін қолданылатын бұрмалану координатасына (байланыс бұрыштары) қарсы.[1][2] Өзгерістерін жоспарлау арқылы молекулалық орбиталық геометриялық өзгерістің функциясы ретінде молекуланың деңгейлері, Уолш диаграммалары белгілі бір кеңістіктік конфигурацияларда молекулалардың неғұрлым тұрақты болатындығын түсіндіреді (мысалы, су неге иілген конформацияны қабылдайды).[3]
Уолш диаграммаларының негізгі қолданылуы - бірдей сандарға ие туыстық молекулалар үшін байқалатын құрылымның заңдылығын түсіндіру валенттік электрондар (мысалы, неге Х2O және H2S ұқсас көрінеді), және олардың молекулалары өздерінің геометрияларын олардың электрондар саны немесе қалай өзгертетіндігін ескеру үшін айналдыру күйі өзгерістер. Сонымен қатар, Уолш диаграммасы арқылы молекулалық геометрияның бұрмалануын болжау үшін қолдануға болады ЛУМО (Ең төменгі иесіз молекулалық орбиталь) әсер етеді ХОМО (Ең жоғары оккупацияланған молекулалық орбиталь) молекула геометриялық толқуды бастан кешіргенде.
Молекулалардың формаларын болжау туралы Уолш ережесінде молекула өзінің HOMO үшін ең тұрақтылықты қамтамасыз ететін құрылымды қабылдайтындығы айтылған. Егер белгілі бір құрылымдық өзгеріс HOMO-ға кедергі келтірмесе, ең жақын орналасқан молекулалық орбиталь геометриялық бағдарға басымдық береді.[4]
Тарих
Уолш диаграммаларын алғаш енгізген А.Д. Уолш, британдық химия профессоры Данди университеті, Химиялық қоғам журналының бір санындағы он мақалалар сериясында.[5][6][7][8][9][10][11][12][13][14] Мұнда ол полиатомиялық молекулалар қабылдаған формаларды рационализациялауды мақсат етті негізгі күй сияқты қозған күйлер, жасаған теориялық үлестерін қолдану арқылы Мулликен. Нақтырақ айтқанда, Уолш молекула формасының өзгеруінің молекулалық орбитальдардың энергиясына әсерін есептеп, түсіндірді. Уолш диаграммалары осындай тәуелділіктің иллюстрациясы болып табылады және оның тұжырымдары «Уолш ережелері» деп аталады.[15]
Өзінің жарияланымдарында Уолш бірнеше мысалдар арқылы молекуланың бастапқы күйінде қабылдаған геометриясы, ең алдымен, оның валенттік электрондарының санына байланысты болатындығын көрсетті.[16] Оның өзі бұл жалпы тұжырымдаманың роман емес екенін мойындады, бірақ оған қол жетімді жаңа мәліметтер алдыңғы жалпылауды кеңейтуге және жетілдіруге мүмкіндік берді деп түсіндірді. Ол сонымен қатар, Мулликен бұрын екі атомдық конфигурациядағы полиатомиялық молекуланың мүмкін орбитальдары үшін корреляциялық диаграмма құруға тырысқанын және тіпті осы сызбаны фигураларды түсіндіру үшін қолдануға тырысқанын атап өтті. спектрлер олардың қозған күйіндегі және қозған күйіндегі молекулалардың[17][18] Алайда, Мулликен белгілі бір қисықтардың көтерілу мен құлау себептерін бұрышының жоғарылауымен түсіндіре алмады, сондықтан Уолш «оның сызбасы эмпирикалық немесе жарияланбаған есептеулерге негізделген» деп мәлімдеді.[5]
Шолу
Бастапқыда Уолш өзінің диаграммаларын «орбиталық байланыстырушы энергия» деп сипаттағанның орнына салу арқылы салған байланыс бұрыштары. Уолш бұл терминмен нені сипаттағаны түсініксіз; кейбіреулер ол шын мәнінде сілтеме жасаған деп санайды иондану потенциалы дегенмен, бұл пікірталас тақырыбы болып қала береді.[19] Қалай болғанда да, ол тұжырымдаған жалпы тұжырымдама: молекуланың жалпы энергиясы сол молекуладағы барлық «орбиталық байланыс энергияларының» қосындысына тең. Демек, орбитальдардың әрқайсысының молекулалық байланыс бұрышының өзгеруі арқылы тұрақтануы немесе тұрақсыздануы туралы білуден молекуланың белгілі бір күйі үшін тепе-теңдік байланыс бұрышын болжауға болады. Бір конфигурацияны тұрақтандыру үшін өзара әрекеттесетін орбитальдар (мысалы, Сызықтық) басқа конфигурацияда (мысалы, Bent) қабаттасуы мүмкін немесе сәйкес келмейді, осылайша бір геометрия екіншісіне қарағанда едәуір тұрақты болады.
Әдетте, негізгі орбитальдар (B, C, N, O, F және Ne үшін 1-ге тең) Уолш диаграммаларынан шығарылады, өйткені олардың энергиясы өте аз болғандықтан, олар байланыс бұрышының өзгеруіне байланысты айтарлықтай өзгеріске ұшырамайды. Тек валенттік орбитальдар қарастырылады. Алайда, валенттік орбитальдардың бір бөлігі көбіне бос болмайтынын есте ұстаған жөн.
Уолш диаграммаларын құру
Уолш диаграммасын дайындау кезінде алдымен молекуланың геометриясын оңтайландыру керек, мысалы Хартри-Фок (HF) әдісі [2] жер күйін жақындатуға арналған толқындық функция және кванттық көп денелі жүйенің негізгі күйдегі энергиясы.[20] Әрі қарай, жоғарыда анықталған тепе-теңдік геометриясынан ығыстырылған геометриялар қатары үшін бір нүктелік энергиялар орындалады. Бір нүктелік энергиялар (SPEs) - есептеулер потенциалды энергетикалық беттер сол молекуладағы атомдардың белгілі бір орналасуы үшін молекуланың. Осы есептеулерді жүргізген кезде байланыстың ұзындығы тұрақты болып қалады (at тепе-теңдік оның тепе-теңдік мәнінен байланыс бұрышын ғана өзгерту керек. Әр геометрия үшін бір нүктелі есептеуді байланыстыру бұрышына қарсы графикке келтіруге болады.
Уолш диаграммасының құрылымы

AH2 Молекулалар
Ең қарапайым AH үшін2 молекулярлық жүйе, Уолш графикалық бейнелеу арқылы бірінші бұрыштық корреляция диаграммасын жасады ab initio Канондық молекулалық орбитальдар үшін байланыс бұрышы 90 ° -дан 180 ° -қа өзгерген кездегі орбиталық энергия қисықтары. Байланыс бұрышы бұрмаланғандықтан, орбитальдардың әрқайсысы үшін энергияны түзулер бойынша жүргізуге болады, бұл молекулалық энергияны конформация функциясы ретінде тез жақындатуға мүмкіндік береді. Уолш ординатасының ядролық отставканы қарастыратын-қарамағандығы әлі белгісіз және бұл пікірталас тақырыбы болып қала береді.[21] Судың болжамды нәтижесі - бұл байланыс бұрышы 90 °, ол тіпті тәжірибелік алынған 104 ° мәніне жақын емес. Ең жақсы жағдайда әдіс майысқан және сызықтық молекуланы ажырата алады.[2]
Осы тұжырымдаманы гидридті емес АВ қоса алғанда, басқа түрлерге де қолдануға болады2 және BAC молекулалары, HAB және HAAH молекулалары, тетраатомды гидрид молекулалары (AH)3), тетраатомды гидридсіз молекулалар (AB), H2АВ молекулалары, ацетальдегид, пентаатомды молекулалар (CH3I), гексаатомды молекулалар (этилен ), және бензол.
Реактивтілік
Бірге Уолш диаграммалары молекулалық орбиталық теория реактивтілікті болжау құралы ретінде де қолданыла алады. Уолш диаграммасын жасап, содан кейін сол молекуланың HOMO / LUMO-ын анықтай отырып, молекуланың қалай әрекет ететінін анықтауға болады. Келесі мысалда Льюис қышқылдығы AH3 BH сияқты молекулалар3 және CH3+ болжалды.
AH алты электрон3 молекулалардың жазықтық конформациясы болуы керек. AH жазықтықтың HOMO, 1e ’екенін көруге болады3 байланысының бұзылуына байланысты А-Н байланысының пирамида пішінін қалыптастыру үшін иілуінде тұрақсыздық пайда болады. Бір атомдық орталықта шоғырланған LUMO - жақсы электронды акцептор және BH-дің Льюис қышқылының сипатын түсіндіреді.3 және CH3+.[22]
Уолштың корреляциялық диаграммаларын туыстықты болжау үшін де қолдануға болады молекулалық орбиталық энергетикалық деңгейлер. Сутегі атомдарының CH жазықтықтан бұрмалануы3+ тетраэдрге дейін CH3-Nu C-Nu байланыстырушы орбиталының тұрақтануын тудырады, σ.[22]
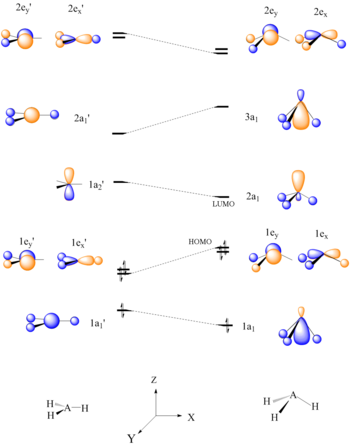 AH жазықтығы үшін Уолш диаграммасы3 молекула |  CH-ға нуклеофильді қосылуға арналған орбиталық өзара әрекеттесу сызбасы3+ |
Басқа корреляциялық диаграммалар
Басқа корреляциялық диаграммалар болып табылады Танабе-Сугано диаграммалары және Orgel диаграммалары.
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ IUPAC, Химиялық терминология жинағы, 2-ші басылым. («Алтын кітап») (1997). Желідегі түзетілген нұсқа: (2006–) «корреляциялық диаграмма ". дои:10.1351 / goldbook.C01348
- ^ а б в Миллер Кэрри С (2015). «Уолш диаграммалары: Физикалық химияға арналған молекулалық орбиталық және құрылымдық есептеу химиясы». Химиялық білім беру журналы. 92: 1040–1043. дои:10.1021 / ed500813d.
- ^ Чен, Е .; Чанг, Т. (1998). «Уолш диаграммасы және облигациялардың орбиталық әдісінің сызықтық комбинациясы». Молекулалық құрылым журналы: THEOCHEM. 431 (1–2): 127–136. дои:10.1016 / S0166-1280 (97) 00432-6.
- ^ Мулликен, Р.С. (1955). «Галоген молекулаларының құрылымдары және жалғыз облигациялардың беріктігі». Дж. Хим. Soc. 77 (4): 884–887. дои:10.1021 / ja01609a020.
- ^ а б Уолш, AD (1953). «Полиатомдық молекулалардың электронды орбитальдары, формалары және спектрлері. I бөлім. AH2 Молекулалар »тақырыбында өтті. Дж.Хем. Soc.: 2260–2266. дои:10.1039 / JR9530002260.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбиталдары, формалары және спектрлері. II бөлім. АВ2 және BAC молекулалары ». Дж.Хем. Soc.: 2266–2288. дои:10.1039 / JR9530002266.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбиталдары, формалары және спектрлері. III бөлім. HAB және HAAH молекулалары». Дж.Хем. Soc.: 2288–2296. дои:10.1039 / JR9530002288.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбитальдары, формалары және спектрлері. IV бөлім. Тетратомды гидрид молекулалары, AH3". Дж.Хем. Soc.: 2296–2301. дои:10.1039 / JR9530002296.
- ^ Уолш, AD (1953). «Полиатомды молекулалардың электрондық орбитальдары, формалары және спектрлері. V бөлім. Тетратомды, гидридті емес молекулалар, А.Б.3". Дж.Хем. Soc.: 2301–2306. дои:10.1039 / JR9530002301.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбиталдары, формалары және спектрлері. VI бөлім. H2АБ молекулалары »атты мақаласында көрсетілген. Дж.Хем. Soc.: 2306–2317. дои:10.1039 / JR9530002306.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбиталдары, формалары және спектрлері. VII бөлім. Ацетальдегидтің ультра күлгін спектрі туралы ескерту». Дж.Хем. Soc.: 2318–2320. дои:10.1039 / JR9530002318.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбитальдары, формалары және спектрлері. VIII бөлім. Бес атомды молекулалар: CH3Мен молекулалар ». Дж.Хем. Soc.: 2321–2324. дои:10.1039 / JR9530002321.
- ^ Уолш, AD (1953). «Полиатомдық молекулалардың электрондық орбиталдары, формалары және спектрлері. IX бөлім. Гексатомдық молекулалар: этилен». Дж.Хем. Soc.: 2325–2329. дои:10.1039 / JR9530002325.
- ^ Уолш, AD (1953). «Полиатомды молекулалардың электрондық орбиталдары, формалары және спектрлері. Х бөлім. Бензол спектрі туралы ескерту». Дж.Хем. Soc.: 2330–2331. дои:10.1039 / JR9530002330.
- ^ Мулликен, Р.С. (1955). «Су және аммиак типті молекулалардағы байланыс бұрыштары және олардың туындылары». Дж. Хим. Soc. 77 (4): 887–891. дои:10.1021 / ja01609a021.
- ^ Уолш, AD (1976). «Шағын полиатомдық молекулалардың электрондық спектрлері туралы кейбір ескертпелер». Int. Аян: физ. Хим., Сер. Екі. 3: 301–316.
- ^ О'Лири, Б .; Мэллион, Р.Б. (1987). «Уолш диаграммалары және Геллман-Фейнман теоремасы: кеш профессор Чарльз А.Кулсонға құрмет, Ф.Р.С. (1910-1974)». Математикалық химия журналы. 1 (4): 335–344. дои:10.1007 / BF01205066.
- ^ Аткинс, П.В. (1970). Молекулалық кванттық механика. Оксфорд, Массачусетс: Кларендон Пресс. ISBN 978-0-19-855129-4.
- ^ Питерс, Д. (1966). «Тәуелсіз электронды молекулалық орбиталық теорияның бір электронды энергиясының табиғаты және Уолш диаграммасы». Фарадей қоғамының операциялары. 6: 1353–1361.
- ^ Чен, Е .; Чанг, Т. (1997). «Орбиталық өзара әрекеттесу және АХ үшін Мульликен-Уолш диаграммасы2 Жүйелер ». Қытай химиялық қоғамының журналы (Тайбэй). 44: 559–565. дои:10.1002 / jccs.199700086.
- ^ Такахата, Ю .; Парр, Р.Г. (1974). «Уолш типіндегі сызбаларды қараудың үш әдісі, оның ішінде ядролық репуляциялар». Жапония химиялық қоғамының хабаршысы. 47 (6): 1380–1386. дои:10.1246 / bcsj.47.1380.
- ^ а б Аткинс, П.В ..; т.б. (1970). Бейорганикалық химия: Шрайвер және Аткинс. Оксфорд, Ұлыбритания: Оксфорд университетінің баспасы. ISBN 978-0-19-926463-6.
