Көлемі реттелетін анион арнасы - Volume-regulated anion channel
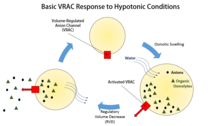
Көлемі реттелетін анион арналары (VRAC) хлор иондары мен түрлі органикалық заттарды тасымалдау арқылы жасуша мөлшерін реттеу үшін өте маңызды осмолиттер, сияқты таурин немесе глутамат, қарсы плазмалық мембрана,[1] және бұл арналармен байланыстырылған жалғыз функция емес. Кейбір зерттеулер VRAC су өткізгіш болуы мүмкін деген болжам жасады.[2]
Жасуша көлемін реттеу тек жасуша қоршаған ортасының өзгеруіне байланысты ісінудің немесе кішіреюдің алдын алу ретінде ғана емес, сонымен қатар жасушаның барлық кезеңдерінде қажет. Клетка көлемінің өзгеруі, мейлі ол ісіну немесе кішірейту болсын, көбінесе экзоциттік инерция немесе плазмалық мембрананың эндоциттік алынуы сияқты үлкен өзгерістерсіз жүреді.[1] Оның орнына көлемді реттеу көбінесе калий, натрий, хлорид және органикалық заттардың тасымалдануы арқылы жүреді осмолиттер мембрана арқылы.[1] Көлемді қоршаған ортаға қатысты реттей алмайтын жасушалардың таралуы өте жақсы, өйткені ісінуге әкеледі лизис, ал қысқару ақыр соңында дегидратациядан апоптоз.[3] VRAC-тің жасуша көлемін реттеудегі ерекше рөлі - бұл жасушалардың көлемінің реттелуі (RVD).[1]
VRAC-ті зерттеу кейбіреулерге олар сүтқоректілердің жасушаларында кеңінен көрінеді және олар барлық жерде көрінуі мүмкін деген қорытындыға келді.[4] Сондай-ақ, VRAC негізгі көлемді реттеуден басқа іргелі ұялы процестерге қатысатыны дәлелденді жасушалардың көбеюі, көші-қон, және апоптоз.[5][6]
Құрылымы мен механизмі
Ғылыми қауымдастық VRAC туралы бұрыннан білсе де,[7] арналардың молекулалық құрамы қандай болатыны жақында ғана анықталды. Олар LRRC8-ден тұрады ақуыз гетеромерлер, оның бес вариациясы бар.[8] Алайда, нақты құрамы LRRC8A, LRRC8B, LRRC8C, LRRC8D, және LRRC8E VRAC дұрыс жұмыс істеуі үшін қажет белгісіз. Тек LRRC8A гексамерикалық VRAC құра алады, ол үшін тышқандар мен адамның нұсқаларында циро-ЭМ құрылымы анықталған.[9][10][11]
Зерттеулер сонымен қатар суббірліктер құрамындағы ауытқулар VRAC белгілі бір тасымалдау қабілетінің өзгеруіне әкелетінін көрсетті. метаболиттер.[12] Мысалы, ішкі бөлім LRRC8D VRAC құрамына кіру көлікпен өте байланысты болды таурин нақты ісікке қарсы препараттармен бірге.[12] Осындай эксперименттердің арқасында біз LRRC8 ақуыздарының VRAC кеуегін де құруы мүмкін екенін білеміз.
VRAC механизміне келетін болсақ, жақында жүргізілген зерттеулер оларды жасушаішілік иондық күштің төмендеуі кезінде белсендіреді деп болжайды, бұл VRAC-тар жасуша көлемінің реттелуімен қатар сенсорлар ретінде де жұмыс істей алады дегенді білдіреді.[13] Алайда, зерттеушілер VRAC активациясында доминантты рөл атқаратын жасушаішілік сигнал беру тетіктерін таба алмады.[3]
LRRC8 ақуыздарының трансмембраналық бөлігі ондағыға ұқсас Паннексиндер.[14]
Нейрондардағы рөлдер
VRAC тек хлоридті ғана емес, сонымен бірге тасымалдау үшін өте маңызды таурин, глутамат, және аспартат.[3][1] Бұл органикалық осмолиттер жасушадан тыс сигнал беру үшін өте маңызды болғандықтан, олар ұялы көлемді реттеу үшін маңызды. Жасушадан тыс сигнал берудегі VRAC рөлін белгілеу үшін біз шығарудың кейбір салдарын талқылауымыз керек глутамат және таурин VRAC құрылғылары айналасында бар нейрондар сәйкесінше.
Үшін глутамат, қозған кезде нейротрансмиттерлер босатылып, айналасындағы арналарды іске қосады нейрондар, бұл шамадан тыс белсенді деполяризацияға, кальций иондарының көбеюіне, ақыр соңында жасушаға әкеледі апоптоз.[3] Мұны әдетте экзототоксикалық деп атайды және ол әдетте нейрондардың ісінуіне әкеледі.[6] Органикалық VRAC шығаруы осмолиттер бұл ісіну мен иондардың келуіне жауап ретінде, оның алдын-алуға көмектеседі нейрон жарылудан, өйткені органикалық емес қосылыстардың жасушадан шығуы тек жасушалық көлемнің шамамен 20-30% төмендеуімен байланысты болды.[15] Сонымен қатар, алдын-алудан басқа лизис нейрон үшін таурин және глутамат насихаттауды жалғастырады экзототоксичность көршіге әсер етеді нейрондар. VRAC-тің рөлі мен реакциясын зерттеуге арналған ең маңызды жасушалар экзототоксичность болып табылады астроциттер. Бұл олардың мидағы нейрондық байланыстың жақтаушылары ретіндегі рөлінде, олардың құрамында VRAC болатындығы дәлелденгендігінде және патологияға жауап ретінде ісінген күйінде табылғандығында. экзототоксичность.[3] Жоғарыда айтылғандай, нейронға ынталандырудың артуы нәтиже береді экзототоксичность, және глутамат бірі болып табылады нейротрансмиттерлер бұл нейрондық реакцияны асыра алуы мүмкін. Бұл ұялы реакцияға байланысты көптеген патологиялар бар, соның ішінде инсульт және гипогликемия басқалардың арасында.[16] Мысал ретінде бірнеше зерттеулер мұны тапты астроциттер VRAC ұялы активациясы инсультпен байланысты заттардың көбеюімен байланысты болуы мүмкін ATP.[17] Эксперименттер VRAC ингибиторлары инсультқа байланысты қозудың босатылуын төмендете алғанын анықтады нейротрансмиттерлер мида;[6] бұл VRAC-тің жасушалық ATP және басқа молекулалардың ұлғаюы арқылы активтенетіндігін білдіреді астроциттер және босату глутамат осы жасушалар арқылы нейрондар айналасында деполяризацияланып, кальций ионының концентрациясын жоғарылатады және өтеді апоптоз.[6]
Басқа органикалық осмолит VRAC-пен байланысты, таурин, сонымен қатар көптеген жасушадан тыс сигнал беру функциялары бар. Нақтырақ айтқанда, шығарылымы деп ойлайды таурин бастап глия VRAC арқылы осмосензирлеуші супраоптикалық ядродағы (SON) көлемді жүйелік реттеуге байланысты.[18] Алдымен зерттеушілер осылай ойлады нейрондар SON-да табылған RVD-ден өту мүмкін болмады, бірақ кейінірек олар белгілі бір уақыттан кейін хлорид-ион тоғын дамытатыны анықталды.[18] Астроциттер осы жаңалыққа байланысты тағы да зерттелді және олар жасушалардың а-ға жауап беретіндігін анықтады гипертониялық шығару арқылы қоршаған орта таурин VRAC тәрізді арналар арқылы.[18] Өз кезегінде, таурин глицинді хлоридті рецепторлық арналарды көрші SON нейрондарында белсендіреді, бұл оларды тудырады гиперполяризациялау.[18] SON нейрондары а-да қысқарады және деполяризацияланады гипертониялық қоршаған орта,[18] арасындағы өзара әрекеттесу астроциттер секрециясының ингибиторы ретінде әрекет етеді вазопрессин SON.
VRAC-да жүргізілген осы зерттеулердің негізінде екеуінде де маңызды экзототоксичность жағдай мен осмосензирлеуші супраоптикалық ядроның (SON) реттелуіне байланысты, бұл каналдың күнделікті нейрондық белсенділікке әсері үлкен. VRAC-лар нейрондық реттеуде көптеген негізгі бөліктерге ие болуы мүмкін; дегенмен зерттеушілерге олардың әсер ету аясын тарылту қиын. Тағы бір маңызды аспект нейрондар калий, хлоридті котранспортерлер (KCCs) басқа ақуыздар болып табылады, олар RVD процесінің бөлігі болып табылады және жасушалар ісінген кезде белсендіріледі.[3][1] Мұны есте ұстаған жөн, өйткені VRAC - бұл жасуша көлемін реттеуге көмектесетін жалғыз молекулалар емес, және соңғы зерттеулер бұл екі арнаның ынтымақтастықта жұмыс істеу ықтималдығы жоғары екенін көрсетті.[3]
Медициналық байланыстар
VRAC-тің көптеген рөлдерін талқылауда көрсетілген байланыстардан басқа нейрондар, зерттеулер жасушалардың кішіреюі көбінесе жасушалардың өлімінен бұрын болатындығын көрсетті (AVD - апоптотикалық көлемнің төмендеуі деп аталады),[19] және VRAC-тің бұл процесте рөл атқаратындығын дәлелдеген зерттеулер болды.[5] Жасушалардың кішіреюін тежеу VRAC тежегіштерімен немесе LRRC8 ақуыздарының жалпы бұзылуымен байланысты болуы мүмкін.[5][19] Бұл тежелу немесе бұзылу ақыр соңында препараттың индуцирленген әсеріне әкеледі апоптоз. Сондықтан VRAC-тер қатерлі ісіктің кейбір түрлерінде дәріге төзімділікте рөл атқара алады.
Байланысты гендер
Әдебиеттер тізімі
- ^ а б c г. e f Jentsch TJ (мамыр 2016). «VRAC және басқа иондық арналар мен тасымалдаушылар жасуша көлемін реттеу кезінде және одан тыс жерлерде». Табиғи шолулар. Молекулалық жасуша биологиясы. 17 (5): 293–307. дои:10.1038 / нрм.2016.29. PMID 27033257.
- ^ Nilius B (қаңтар 2004). «VRAC көлемімен реттелетін анион каналы» су өткізгіш «арна ма?». Нейрохимиялық зерттеулер. 29 (1): 3–8. дои:10.1023 / B: NERE.0000010430.23137.be. PMID 14992260.
- ^ а б c г. e f ж Монгин А.А. (наурыз 2016). «Көлемі реттелетін анион каналы - ми ішіндегі ашуланшақтық». Pflügers Archiv. 468 (3): 421–41. дои:10.1007 / s00424-015-1765-6. PMC 4752865. PMID 26620797.
- ^ Nilius B, Sehrer J, Viana F, De Greef C, Raeymaekers L, Eggermont J, Droogmans G (қазан 1994). «Әр түрлі сүтқоректілердің қоздырғышсыз клеткалар типтеріндегі көлемді-белсенді токтар». Pflügers Archiv. 428 (3–4): 364–71. дои:10.1007 / BF00724520. PMID 7816559.
- ^ а б c Eggermont J, Trouet D, I Carton, Nilius B (желтоқсан 2001). «Көлемдік реттелетін аниондық арналардың жасушалық қызметі және бақылауы». Жасушалық биохимия және биофизика. 35 (3): 263–74. дои:10.1385 / CBB: 35: 3: 263. PMID 11894846.
- ^ а б c г. Inoue H, Okada Y (ақпан 2007). «Экситотоксикалық нейрондық зақымдану кезіндегі көлемге сезімтал хлоридті каналдың рөлі». Неврология журналы. 27 (6): 1445–55. дои:10.1523 / JNEUROSCI.4694-06.2007. PMC 6673589. PMID 17287519.
- ^ Nilius B, Eggermont J, Voets T, Buyse G, Manolopoulos V, Droogmans G (1997). «Сүтқоректілер клеткаларындағы көлеммен реттелетін анион арналарының қасиеттері». Биофизика мен молекулалық биологиядағы прогресс. 68 (1): 69–119. дои:10.1016 / S0079-6107 (97) 00021-7. PMID 9481145.
- ^ Voss FK, Ullrich F, Münch J, Lazarow K, Lutter D, Mah N, Андраде-Наварро М.А., фон Kries JP, Stauber T, Jentsch TJ (мамыр 2014). «LRRC8 гетеромерлерін VRAC көлемімен реттелетін аниондық каналдың маңызды компоненті ретінде анықтау» (PDF). Ғылым. 344 (6184): 634–8. Бибкод:2014Sci ... 344..634V. дои:10.1126 / ғылым.1252826. PMID 24790029.
- ^ Денека, Д; Савика, М; Lam, AKM; Паулино, С; Dutzler, R (маусым 2018). «LRRC8 отбасының көлемімен реттелетін аниондық каналының құрылымы». Табиғат. 558 (7709): 254–259. Бибкод:2018 ж .558..254D. дои:10.1038 / s41586-018-0134-ж. PMID 29769723.
- ^ Кефаувер, Дж .; Саотом, К; Дубин, AE; Паллесен, Дж; Котрелл, Калифорния; Кахалан, СМ; Qiu, Z; Хонг, Г; Кроули, КС; Уитвэм, Т; Ли, WH; Уорд, АБ; Патапутиан, А (10 тамыз 2018). «Анион арнасының адам көлемінің құрылымы». eLife. 7. дои:10.7554 / eLife.38461. PMC 6086657. PMID 30095067.
- ^ Касуя, Г; Накане, Т; Йокояма, Т; Джиа, У; Иноуэ, М; Ватанабе, К; Накамура, Р; Нишизава, Т; Кусакизако, Т; Цуцуми, А; Янагисава, Н; Дохма, Н; Хаттори, М; Ичижо, Н; Ян, З; Киккава, М; Ширузу, М; Ишитани, Р; Нуреки, О (қыркүйек 2018). «LRRC8 адам көлемінің реттелетін аниондық каналының крио-ЭМ құрылымдары». Табиғат құрылымы және молекулалық биология. 25 (9): 797–804. дои:10.1038 / s41594-018-0109-6. PMID 30127360.
- ^ а б Planells-Cases R, Lutter D, Guyader C, Gerhards NM, Ullrich F, Elger DA, Kucukosmanoglu A, Xu G, Voss FK, Reincke SM, Stauber T, Blomen VA, Vis DJ, Wessels LF, Brummelkamp TR, Borst P, Rottenberg S, Jentsch TJ (желтоқсан 2015). «VRAC арналарының суббірлік құрамы субстраттың ерекшелігін және Pt негізіндегі ісікке қарсы дәрілерге жасушалық төзімділікті анықтайды». EMBO журналы. 34 (24): 2993–3008. дои:10.15252 / embj.201592409. PMC 4687416. PMID 26530471.
- ^ Махаббат L (қараша 1977). «Қарау терезесі». Иллинойс медициналық журналы. 152 (5): 5298–5303. PMID 21858.
- ^ Абаскаль, F; Zardoya, R (шілде 2012). «LRRC8 ақуыздары паннексиндермен ортақ атадан тұрады және жасуша байланысына қатысатын гексамериялық арналар түзуі мүмкін». BioEssay: молекулалық, жасушалық және даму биологиясындағы жаңалықтар мен шолулар. 34 (7): 551–60. дои:10.1002 / bies.201100173. hdl:10261/124027. PMID 22532330.
- ^ MA моделі (наурыз 2014). «Апоптотикалық көлемнің төмендеуінің мүмкін себептері: сандық шолу жасау». Американдық физиология журналы. Жасуша физиологиясы. 306 (5): C417-24. дои:10.1152 / ajpcell.00328.2013. PMID 24196536.
- ^ Choi DW (қазан, 1988). «Глутаматтың нейроуыттылығы және жүйке жүйесі аурулары». Нейрон. 1 (8): 623–34. дои:10.1016/0896-6273(88)90162-6. PMID 2908446.
- ^ Хизински-Гарсия MC, Рудкоуская А, Монгин А.А. (қараша 2014). «LRRC8A ақуызы егеуқұйрық астроциттеріндегі қоздырғыш аминқышқылдарының ісінуі және АТФ әсерінен босатылуы үшін өте қажет». Физиология журналы. 592 (22): 4855–62. дои:10.1113 / jphysiol.2014.278887. PMC 4259531. PMID 25172945.
- ^ а б c г. e Katz RS, Baker DH (қыркүйек 1975). «Балапандағы метиониннің уыттылығы: қоректік және метаболикалық салдары». Тамақтану журналы. 105 (9): 1168–75. дои:10.1111 / j.1469-7793.1997.609bj.x. PMC 1159532. PMID 9279812.
- ^ а б Maeno E, Ishizaki Y, Kanaseki T, Hazama A, Okada Y (тамыз 2000). «Көлемді реттеудің реттелмегендігі салдарынан клеткалардың кішіреюі апоптоздың ерте алғышарты болып табылады». Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 97 (17): 9487–92. дои:10.1073 / pnas.140216197. PMC 16891. PMID 10900263.
