Натрий метабисульфиті - Википедия - Sodium metabisulfite
 | |
 | |
 | |
| Атаулар | |
|---|---|
| Басқа атаулар Натрий пиросульфиті Натрий дисульфиті | |
| Идентификаторлар | |
3D моделі (JSmol ) | |
| Чеби | |
| ЧЕМБЛ | |
| ECHA ақпарат картасы | 100.028.794 |
| EC нөмірі |
|
| E нөмірі | E223 (консерванттар) |
PubChem CID | |
| RTECS нөмірі |
|
| UNII | |
CompTox бақылау тақтасы (EPA) | |
| |
| |
| Қасиеттері | |
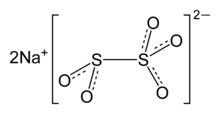
| Na2S2O5, Na-O- (S = O) -O- (S = O) -O-Na | |
| Молярлық масса | 190.107 г / моль |
| Сыртқы түрі | Ақтан сарыға дейін ұнтақ |
| Иіс | Әлсіздік СО2 |
| Тығыздығы | 1.48 г / см3 |
| Еру нүктесі | 170 ° C (338 ° F; 443 K) ыдырау 150 ° C-тан басталады |
| |
| Ерігіштік | Өте жақсы ериді глицерин Ішінде аздап ериді этанол |
| Қауіпті жағдайлар | |
| Қауіпсіздік туралы ақпарат парағы | Mallinckrodt MSDS |
| GHS пиктограммалары |   |
| GHS сигналдық сөзі | Қауіп |
| H302, H318 | |
| P264, P270, P280, P301 + 312, P305 + 351 + 338, P310, P330, P501 | |
| NFPA 704 (от алмас) | |
| NIOSH (АҚШ денсаулығына әсер ету шегі): | |
PEL (Рұқсат етілген) | Жоқ[1] |
REL (Ұсынылады) | TWA 5 мг / м3[1] |
IDLH (Шұғыл қауіп) | Н.Д.[1] |
| Байланысты қосылыстар | |
Басқа аниондар | Натрий сульфиті Натрий бисульфиті |
Басқа катиондар | Калий метабисульфиті |
Байланысты қосылыстар | Натрий дитиониті Натрий тиосульфаты Натрий сульфаты |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
Натрий метабисульфиті немесе натрий пиросульфиті (IUPAC емлесі; Br. E. натрий метабисульфиті немесе натрий пиросульфиті) болып табылады бейорганикалық қосылыс химиялық формуланың Na2S2O5. Затты кейде деп атайды натрий метабисульфит. Ол а ретінде қолданылады дезинфекциялаушы, антиоксидант, және консервант агент.[2]
Дайындық
Натрий дисульфитін ерітіндімен өңдеу арқылы дайындауға болады натрий гидроксиді бірге күкірт диоксиді.[3] Жылы суда өткізгенде, Na2СО3 бастапқыда сары қатты зат түрінде тұнбаға түседі. Қосымша SO2, қатты зат дисульфит беру үшін ериді, ол салқындаған кезде кристалданады.[4]
- СО2 + 2 NaOH → Na2СО3 + H2O
- СО2 + Na2СО3 → На2S2O5
ол түссіз қатты Na қалдықтарын береді2S2O5.
Химиялық құрылым
Анион метабисульфит SO-дан тұрады2 SO-ға байланысты топ3 теріс заряды SO-да локализацияланған топ3 Соңы. S – S байланысының ұзындығы 2,22 Å, ал «тионат» және «тионит» S – O арақашықтықтары сәйкесінше 1,46 және 1,50 are құрайды.[5]
Реактивтілік
Суда ерігенде бисульфит пайда болады:
- Na2S2O5 + H2O → 2 Na+ + 2 HSO3−
Қолданады
Натрий және калий метабисульфиті көптеген негізгі және тауашалық мақсаттарға ие. Ол кеңінен қолданылады тамақ пен сусындарды сақтау.
- Натрий метабисульфиті ретінде қосылады көмекші зат құрамында адреналин бар дәрі-дәрмектерге (адреналин ), адреналиннің тотығуын болдырмау мақсатында.[6] Мысалы, ол қосылады аралас препарат құрамында а жергілікті анестетик және адреналин,[6] және формулаға эпинефринді автоинжекторлар мысалы, EpiPen.[7] Бұл құрамның жарамдылық мерзімін ұзартады,[6] натрий метабисульфиті адреналинмен әрекеттесіп, оның ыдырап, эпинефрин сульфонатын түзетініне қарамастан.[8]
- Ол фотосуретте қолданылады.[9]
- Шоғырланған натрий метабисульфитін жою үшін қолдануға болады ағаш кесектері. Кейбір брендтерде 98% натрий метабисульфиті бар және олардың ыдырауын тудырады лигнин алып тастауды жеңілдететін күрекшелерде.[10]
- Ол сондай-ақ көмекші зат кейбірінде таблеткалар, сияқты парацетамол.
- Бұл заттың денсаулыққа қатысты өте маңызды аспектісі - оны қан анализіне қосуға болады орақ жасушаларының анемиясы (және басқа ұқсас нысандары гемоглобин мутация ). Заттар бұзылған жасушаларды ораққа әкеледі (кешен арқылы) полимеризация ) демек, ауруды растайтын.
- Ол кокос кремі өндірісінде ағартқыш агент ретінде қолданылады
- Табиғи талшықтардан жасалған киімнің кішірейтілген заттарындағы сульфидті байланыстарды бұзу үшін тотықсыздандырғыш ретінде қолданылады, осылайша киімнің жуудан кейін бастапқы қалпына келуіне мүмкіндік береді.
- Ол SO ретінде қолданылады2 цианидті коммерциялық жолмен жоюға арналған көз (ауа немесе оттегімен араласқан) алтын цианидтеу процестер.
- Ол хлордың қалдықтарын сөндіру үшін суды тазарту саласында қолданылады
- Микроқұрылымдық талдауға арналған темір негізіндегі металл сынамаларын бояуға арналған.[11][12]
- Ол аяқ киім мен киім сияқты тұтыну тауарларын тасымалдау кезінде микробқа және зеңнің алдын-алуға арналған фунгицид ретінде қолданылады. Пластикалық жапсырмалар мен қаптамалар (мысалы, Micro-Pak)™) құрамында құрамында сусыз, натрий метабисульфитінің қатты белсенді ингредиенті тасымалдауға дейін қосылады. Құрылғылар тасымалдау кезінде атмосферадан ылғалды сіңіреді және аз мөлшерде күкірт диоксидін шығарады.[13]
- Ол жемістерді тасымалдау кезінде сақтау үшін қолданылады.[14]
Әдебиеттер тізімі
- ^ а б c Химиялық қауіптерге арналған NIOSH қалта нұсқаулығы. "#0566". Ұлттық еңбек қауіпсіздігі және еңбекті қорғау институты (NIOSH).
- ^ Барбера, Хосе Хименес; Мецгер, Адольф; Қасқыр, Манфред (2000). «Сульфиттер, тиосульфаттар және дитионитель химиясы». Ульманның өндірістік химия энциклопедиясы. Вайнхайм: Вили-ВЧ. дои:10.1002 / 14356007.a25_477.
- ^ Кэтрин Э. Хаусрофт; Алан Г.Шарп (2008). «16 тарау: 16 топ элементтері». Бейорганикалық химия, 3-шығарылым. Пирсон. б. 520. ISBN 978-0-13-175553-6.
- ^ Джонстон, Х. Ф. (1946). «Сілтілік металдардың сульфиттері мен пиросульфиттері». Бейорганикалық синтездер. Бейорганикалық синтездер. 2. 162–167 беттер. дои:10.1002 / 9780470132333.ch49. ISBN 9780470132333.
- ^ К.Л. Картер, Т.А. Сиддик, К.Л. Мерфи, Д.В. Беннетт «Натрий метабисульфитінің таңқаларлықтай ұсталмайтын кристалдық құрылымы» Acta Crystallogr. (2004). B60, 155–162. дои:10.1107 / S0108768104003325
- ^ а б c McGee, Дуглас Л. (2013). «Жергілікті және жергілікті наркоз». Робертсте Джеймс Р .; Джеррис, Р. Хеджес (ред.) Робертс пен Хедждің жедел медициналық көмек кезіндегі клиникалық процедуралары (6-шы басылым). Elsevier / Сондерс. б. 519. ISBN 9781455748594.
- ^ Ниази, Сафараз К. (2009). Фармацевтикалық өндіріс формулаларының анықтамалығы. 6 том, Стерильді өнімдер (2-ші басылым). Нью-Йорк: денсаулық туралы ақпарат. б. 410. ISBN 9781420081312.
- ^ Барнс, Эндрю Р. (2013). «48-тарау. Дәрілік формадағы химиялық тұрақтылық». Олтонда Майкл Э .; Тейлор, Кевин М.Г. (ред.). Олтонның фармацевтика: дәрі-дәрмектерді жобалау және өндіру (4-ші басылым). Черчилль Ливингстон / Эльзевер. б. 833. ISBN 9780702053931.
- ^ Анчелл, Стив (2008). Қараңғы бөлмеге арналған тағамдар кітабы (3-ші басылым). Амстердам: Focal Press. бет.193. ISBN 978-0240810553.
- ^ http://www.bonideproducts.com/lbonide/msds/sds271.pdf
- ^ «Түсті металлография». 2011-05-04.
- ^ https://www.asminternational.org/documents/10192/1874035/htp00102p025.pdf/ace8f01d-bf9a-4048-b948-a3aeb2d8a536
- ^ «Micro-Pak жақсартылған орам жапсырмалары» (PDF). 2020-05-05.
- ^ «Дақтан кейінгі биология және тропикалық және субтропикалық жемістердің технологиясы». 2020-05-05. дои:10.1533/9780857092885.361. Журналға сілтеме жасау қажет
| журнал =(Көмектесіңдер)

