Q-FISH - Q-FISH
Сандық флуоресцентті орнында будандастыру (Q-FISH) - бұл цитогенетикалық дәстүрліге негізделген техника БАЛЫҚ әдістеме. Q-FISH-те техника ((Cy3 немесе FITC ) синтетикалық ДНҚ деп аталады пептидтік нуклеин қышқылы (PNA) олигонуклеотидтер мақсатты реттіліктің санын анықтау хромосомалық ДНҚ қолдану люминесценттік микроскопия және талдау бағдарламалық қамтамасыздандыру. Q-FISH көбінесе зерттеу үшін қолданылады теломера ұзындығы, ол омыртқалылар бұл хромосомалардың дистальды соңында орналасқан қайталанатын гексамериялық тізбектер (TTAGGG). Теломерлер хромосоманың ұштарында ДНҚ-ның зақымдану реакциясын болдырмау үшін қажет геномның тұрақсыздығы. Бүгінгі күнге дейін Q-FISH әдісі теломераларды зерттеу саласында қолданылуда.
PNA және FISH
РНҚ омыртқаларында зарядталған фосфат топтары жоқ болғандықтан, РНҚ мен ДНҚ арасындағы байланыс ДНҚ / ДНҚ немесе ДНҚ / РНҚ дуплекстеріне қарағанда күшті. Q-FISH ПНҚ-ға тән осы ерекше сипаттаманы пайдаланады, мұнда аз иондық күш кезінде РНҚ комплементарлы бір тізбекті ДНҚ тізбегіне қосыла алады, ал бір тізбекті ДНҚ жасай алмайды. Тек таңбаланатын жағдайларды қолдану арқылы (CCCTAA)3 Гибридтелетін PNA (TTAGGG)n мақсатты реттіліктер, Q-FISH телемериялық тізбектерге ПНҚ будандастыру мөлшерін анықтауға қабілетті.
Өсірілетін жасушаларға арналған жалпы әдіс / хаттама[1]
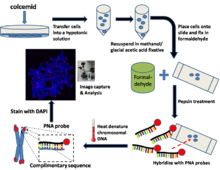
Метафаза ұсталған жасушаларды дайындаңыз
Егін жинауға бірнеше сағат қалғанда мәдениетті жасушалар, колцемид қоректік ортаға қосылады. Колцемид ішіндегі жасушаларды ұстауға әсер етеді метафаза бұзу арқылы күй микротүтікшелер жылы митоздық жасушалар. Ұяшықтар сол кезде трипсинизацияланған және а. қайта тоқтатылды гипотоникалық буфер. Бұл жиналған жасушаларды ісіндіріп, хромосомаларды таратады.
Ұяшықтарды бекіту
Содан кейін гипотоникалық ерітінді центрифугалау әдісімен жойылып, метанол / мұздық сірке қышқылын бекітетін затқа қайта енгізіледі.
Слайдтар дайында
Жасуша суспензиясының бірнеше тамшысын микроскоптың сырғымасына қойып, ауаны түні бойы құрғатыңыз. Келесі күні слайды батырыңыз фосфат буферлі тұзды ерітінді (PBS) бірнеше минут.
Формальдегидтегі слайдтарды бекітіңіз
Слайдтарды 4% -ға ауыстырыңыз формальдегид шешім және түзету бірнеше минут. PBS көмегімен слайдтарды бірнеше рет жуыңыз.
Слайдтарды пепсинмен өңдеңіз
Содан кейін слайдтар а-ға ауыстырылады пепсин шешім. Пепсин - а протеаза және ақуыздарды пептидтерге сіңіруге әсер етеді.
ПНҚ зондын будандастырыңыз (Cy3 немесе FITC белгіленген PNAs)
Будандастыру қоспасының кішкене бөлігі жабындыға қойылады, содан кейін микроскоптың бекітілген ұяшықтары бар слайдқа ақырын орналастырылады.
ДНҚ жылу денатурациясы
Содан кейін слайд жасушадағы хромосомалық ДНҚ орналасқан алдын ала қыздырылған пешке орналастырылады денатуратталған 80 ° C температурада бірнеше минут. Содан кейін слайд бөлме температурасында бірнеше сағатқа қалдырылып, РНҚ-ны комплементарлы ДНҚ-ға будандастыруға мүмкіндік береді.
Байланыстырылмаған ПНҚ-ны және ДНҚ-ға қарсы дақтарды кетіру үшін слайдтарды жуыңыз (DAPI немесе PI)
Содан кейін слайдтар байланыстырылмаған РНҚ-ны кетіру үшін әр түрлі жуу ерітінділерінде мұқият жуылады. Содан кейін микроскопты орнату ортасы ұяшықтарға орналастырылады. Бұл ортада әдетте бар DAPI (ДНҚ-ға қарсы дақ) және РНҚ флуоресценциясын сақтау және азайту үшін антифад ерітіндісі ақшылдау.
Кескін түсіру және талдау
Тәжірибелік сынамалар түсірілмес бұрын, камера мен флуоресцентті микроскоптың дұрыс орнатылуын қамтамасыз ету үшін люминесцентті анықтамалық моншақтар түсіріледі. Сонымен қатар, бұл анықтамалық моншақтар әрбір сатып алу сессиясының алдында кескінделетін болады. Бұл үлгілер арасындағы айырмашылық шамдағы немесе фотокамерадағы қателіктерге байланысты болмайтындығына кепілдік береді.[2] Содан кейін метафаза ұяшығы қолмен таңдалады және камераның ортасына орналастырылады. Кескіндердің екі түрі алынады: боялған хромосомалардың метафаза күйіндегі суреттері және теломерлердің люминесценттік бейнелері. Содан кейін екі кескінді біріктіріп кескін жасауға болады. Бұл сурет содан кейін болуы мүмкін кариотиптелген немесе тағайындалған номенклатура. Сонымен қатар, теломера ұзындығының хромосомалық ішкі таралуы p-қару мен q-қару өлшеуге болады.[2]
Әр түрлі тәжірибелерден алынған мәліметтер флуоресценция қарқындылығын қалыпқа келтіру үшін пайдаланылуы мүмкін плазмидалар белгілі теломериялық қайталанулар саны бар, теломердің флуоресценциясы мен теломерінің ұзындығын анықтауға көмектесетін стандарттар ретінде қолданыла алады. Флуоресцентті анықтамалық моншақтардан басқа, апа-хроматидтерден сигнал күші тең болуы керек, сондықтан деректердің дәлдігін өлшеу үшін тағы бір бақылау ретінде қолдануға болады. Соңында, суреттер қанықпаған маңызды. Егер флуоресценция қарқындылығы қанықтыққа жетсе, теломердің ұзындығы жете бағаланбайды.[1] Q-FISH кескінді талдау бағдарламалық жасақтамасы Flintbox желісінен тегін қол жетімді [1].
Қолданылуы және маңызы
Q-FISH теломердің ұзындығының таралуы және оны әртүрлі аурулармен байланыстыру туралы ақпаратты сандық бағалау үшін кеңінен қолданылған. Бұл тұрғыда Q-FISH өте маңызды, өйткені ол өте қысқа теломерлерді анықтай алады және олардың санын анықтай алады. Теломерлердің дисфункциясы кезінде теломерлердің орташа ұзындығына емес, осы сыни қысқа теломерлердің жиілігі маңызды екендігі көрсетілген.[3][4]
Q-FISH теломерлердің ұзындығы туралы нақты ақпаратпен қамтамасыз етсе де, оның маңыздылығын Q-FISH-ті басқа балық аулауға қатысты техникамен біріктіру арқылы кеңейтуге болады, мысалы. ағын-БАЛЫҚ. Ағымдағы FISH, ағындық цитометрия Q-FISH ішіндегі аз ғана жасушадан гөрі, көптеген жасушалардағы флуоресценция интенсивтілігін (және, осылайша, теломердің ұзындығын) өлшеу үшін қолданылады. Керісінше, Q-FISH-тен айырмашылығы, flow-FISH жеке жасуша ішіндегі белгілі бір хромосомадағы теломердің ұзындығын анықтай алмайды.[5] Дегенмен, Q-FISH әдетте төмен өткізу қабілеті деп саналса да, популяцияны зерттеу үшін жарамсыз болса да, топтар 96-қабатты пластиналардағы интерфазалық ядроларда Q-FISH-ті орындау үшін автоматтандырылған техниканы қолданатын жоғары өнімді (HT) Q-FISH протоколдарын жасады.[6]
Сол сияқты Q-FISH-пен бірге қолдануға болатын мультиплекс-FISH және cenM-FISH сияқты басқа әдістер жасалды. Multiplex-FISH 24 хромосоманы әр түрлі түстерде елестету және анықтау үшін әртүрлі зондтарды қолданады ішкі немесе хромосомалық қайта құрылымдау.[7] Центромераға тән көп түсті FISH (cenM-FISH) мультиплекс-FISH сияқты түрлі-түсті зондтарды қолданады центромера центромералық аймақтарды анықтау және ажырату үшін арнайы белгіленген зондтар. Центромера аномалиялары немесе хромосомалық қайта құрылымдар мен теломердің ұзындығы арасындағы байланыс жоғары клиникалық әсер етуі мүмкін, өйткені олардың бәрі босанғанға дейінгі немесе кейінгі диагностикада және ісік дамуында маңызды болып көрінеді.[8] Бұл тәжірибелер теломерлердің рөлі және теломера ұзындығының маңыздылығы туралы көбірек мағлұмат бере алады.
Q-FISH-тің тағы бір қолданылуы - бұл хромосомалардың ұштары теломерада біріктірілген теломерлік синтездерді анықтау, оларды кейде интерстициальды (хромосома шегінде) теломериялық тізбектер деп атайды (ITS). Теломериялық синтездерді зерттеу кейде эволюция барысын көрсете алады. Мысалы, адамның бір хромосомасында ITS бар, ол гиппотеза бойынша біріктірілген шимпанзелердегі екі хромосоманың баламасы. Әр түрлі түрлердегі теломера ұзындығының реттелуін байқау сонымен қатар кариотип эволюциясы және адам ауруларына сәйкестігі туралы маңызды ақпаратты ашады.[2]
Басқа мысалда гомологты емес қосылу (NHEJ) ақуызды қалпына келтіру екі тізбекті ДНҚ үзіледі және сүйенеді Ку70 /Ку80 гетеродимер жұмыс істеу. Бұл ақуыздарды бұзу теломериялық қысқаруды тудырады, оны теломердің ұзындығын FISH көмегімен өлшеу арқылы байқауға болады. Мысалы, Ku 80 гені жоқ тышқандарда теломера ұзындығы qFISH арқылы өлшенеді және айтарлықтай қысқарады.[9]
Q-FISH әдетте қолданылады қатерлі ісік қатерлі және қатерлі ісік жасушаларының арасындағы теломер ұзындығының айырмашылықтарын өлшеу бойынша зерттеулер. Теломердің қысқаруы геномдық тұрақсыздықты тудырады және қартайған сайын табиғи түрде пайда болады, бұл екі фактор да қатерлі ісік ауруларының себептерімен корреляцияланады.[10]
Q-FISH артықшылықтары
Q-FISH-тің басқа FISH техникаларына қарағанда ең үлкен артықшылығы - техниканың сандық қабілеттілігі. ДНҚ зондтарын қолданатын дәстүрлі FISH-пен салыстырғанда сандық ақпарат алу қиын, себебі будандастыру зондтары компенаментті геномдық ДНҚ тізбектерінің ренатурациясымен бәсекелеседі. Сондықтан, PNA-ны қолдану және оларды өте қатаң жағдайда будандастыру арқылы бұл мәселені жеңуге мүмкіндік береді. Сол сияқты, РНҚ зондының қатысуымен хромосомалық ДНҚ денатурациялауға қабілетті болғандықтан, FISH процедурасын жеңілдетеді. Сонымен қатар, әдіс пайдаланушыға әрбір жеке хромосоманың теломера ұзындығын тексеруге мүмкіндік беретін үлкен ажыратымдылықты қамтамасыз етеді (p немесе q қолы ) белгілі бір ұяшықта. Сонымен қатар, айырмашылығы Оңтүстік блоттар бұл 10-нан асуы керек5 дақтар үшін жасушалар, Q-FISH-та 30-дан аз жасушалар қажет.
Q-FISH кемшіліктері
Артықшылықтарына қарамастан, Q-FISH өте көп еңбекті қажет етеді және жоғары өнімділікті талдауға жарамсыз. Техника жақсы дайындалған метафаза жасушаларына байланысты және сандық өлшем дәл болуы үшін жабдық пен үлгілерді дұрыс баптау / қалыпқа келтіру өте маңызды. Сонымен қатар, жасушалардың аз мөлшері қажет болғанымен, метафазада бірден жеткілікті мөлшерді алу қиын. Сонымен қатар, кедей хромосома морфологиясы дайындық кезінде жоғары температураға шамадан тыс әсер етуден туындауы мүмкін. Дәл сол сияқты, егер біреу әртүрлі ұяшық типтерін қолданса, Q-FISH-тегі көптеген кезеңдер (мысалы, колцемидпен емдеу ұзақтығы) оңтайландыруды қажет етеді.[1]
Флуоресценттік микроскопиядағы жиі кездесетін мәселе ақшылдау, қайда фторофор жарықтың әсерінен белсенділігін жоғалтады. Бұл флуоресценция қарқындылығын дәл өлшеуге әкелуі мүмкін. Фотосуреттерді ағарту, жарық көзінің тұрақтылығы және жүйенің өзгергіштігі - бұл қате көзі, бірақ егер пайдаланушы үлгілер арасындағы сатып алу уақытын қысқартып, тиісті басқару элементтерін қоса алса, оны азайтуға болады.[1]
Классикалық техника
Q-FISH және PNA дамымас бұрын, теломердің ұзындығын өлшеудің классикалық әдісі қолданылған Оңтүстік блоттар. Бұл әдіс арқылы геномдық ДНҚ қорытылады шектеу ферменттері және бөлінген гель электрофорезі. Содан кейін ДНҚ мембранаға ауыстырылып, радиоактивті немесе люминесцентті теломерлі ДНҚ зондтарының көмегімен будандастырылады. Алайда, бұл әдіс тек жасуша популяциясындағы орташа теломера ұзындығын бағалауға қабілетті және геномда интерстициалды теломериялық тізбектердің болуы дәл емес өлшеулерге әкелуі мүмкін.[1]
Q-FISH нұсқалары
Flow-FISH
Q-FISH сияқты, Flow-FISH бұл PNA-ны қолдануды ағындық цитометриямен біріктіретін Q-FISH бейімделуі. Бұл әдісте Flow-FISH қолданады интерфаза емес, ұяшықтар метафаза хромосомалар және суспензиядағы РНҚ зондтарын будандастырады. Будандастырудан кейін салыстырмалы түрде қысқа уақыт ішінде ағындық цитометрде мыңдаған жасушаларды талдауға болады. Алайда, Flow-FISH әр ұяшық үшін орташа теломериялық ұзындықты ғана қамтамасыз етеді, ал Q-FISH жеке хромосоманың теломер ұзындығын талдай алады.

PNA-FISH
Q-FISH-тің сандық қабілеті көбінесе теломерлерді зерттеуде қолданылатынына қарамастан, тек сапалы мәліметтерді қажет ететін басқа салалар зерттеу және диагностикалық мақсаттарда FISH-пен бірге PNA-ны қолдануды қабылдады. Жұқпалы ауруларды клиникада жылдам анықтау және диагностикалау үшін PNA-FISH анализдері жасалды. Дәстүрлімен үйлеседі граммен бояу қанның жағымды дақылдарының, РНҚ түрге тән мақсат үшін қолданыла алады рРНҚ (рибосомалық РНҚ) бактериялардың немесе ашытқылардың әртүрлі штамдарын анықтау үшін.[11] Тестті салыстырмалы түрде тез жүргізуге болатындықтан, сынауды ауруханадан шыққан инфекциялар туындауы мүмкін ауруханаларда қолдану қарастырылуда.
CO-FISH (хромосома бағыты-FISH)
ПНҚ мен FISH-ті қолданатын тағы бір бейімделу хромосомаларды РНҚ-мен нақты таңбалауға мүмкіндік беретін CO-FISH (хромосома бағдары-FISH) деп аталады. Бұл әдіс ДНҚ-ның жаңадан репликацияланған тізбектерін таңдап алып тастауды білдіреді (қолдану арқылы BrdU инкорпорация), нәтижесінде тек бір жолақты мақсатты ДНҚ пайда болады. Әр түрлі түсті PNA зондтарын қолдану арқылы апа-хроматидтерді ерекше таңбалау мүмкін болады.[12][13]
Әдебиеттер тізімі
- ^ а б c г. e Пун, ССС. және Lansdorp, PM (2001) «Орнында сандық флуоресценттік будандастыру». Ағымдағы хаттамалар Жасуша биологиясында (Оңтүстік Калифорния университеті, Лос-Анджелес, Калифорния, АҚШ: Джон Вили және ұлдары, Инк.) 18-тарау (2001) 18.4.1-18.4.21-бөлім.
- ^ а б c Слижепчевич, Предраг. «Q-FISH арқылы теломера ұзындығын өлшеу.» Жасуша ғылымындағы әдістер (2001) 23: 17-22
- ^ Хеманн Мт., Стронг, МА., Хао, Лай., Грейдер, КВ. «Теломердің орташа ұзындығы емес, ең қысқа теломер жасушаның өміршеңдігі мен хромосоманың тұрақтылығы үшін өте маңызды». Ұяшық (2001) 107:67-77.
- ^ Сампер, Э., Флорес, Дж., Бласко, MA. «Теломеразаның белсенділігін қалпына келтіру қысқа теломерлері бар тышқандардағы хромосомалық тұрақсыздық пен ерте қартаюды құтқарады». EMBO Rep (2001) 2:800-807.
- ^ Baerlocher, GM., Vultro, I., de Jong, G., Lansdorp, PM. «Теломерлердің орташа ұзындығын өлшеуге арналған цитометрия мен балық аулау». Табиғат хаттамалары (2006) 1(5):2365-2376.
- ^ Канела, А., Вера, Е., Клатт, П., Бласко, MA. «FISH көмегімен теломердің жоғары ұзындығын сандық анықтау және оны халықтың популяциясын зерттеуге қолдану». PNAS (2007) 104(13):5300-5305.
- ^ Uhrig, S., Schuffenhauer, S., Fauth, C., Wirtz, A., Daumer-Haas, C., Apacik, C., Cohen, M., Müller-Navia, J., Cremer, T., Murken , Дж. Және Speicher, MR. «Мультиплекс-FISH туылғанға дейінгі және кейінгі диагностикалық қосымшалар үшін.» Американдық генетика журналы (1999) 65: 448-462.
- ^ Ниццель, А., Рокки, М., Старке, Х., Хеллер, А., Фильдер, В., Влодарская, И., Лонкаревич, IF., Беенсен, В., Клауссен, У., және Лихер, Т. «Маркер хромосомаларын сипаттауға арналған жаңа көп түсті FISH тәсілі: центромераға тән көп түсті-FISH (cENM-FISH).» Адам генетикасы (2001) 108: 199-204.
- ^ Фагана, Ф., Ханде, депутат., Тонг, Вм., Рот, Д., Лансдорп, Премьер-Министр, Ванг, ZQ. Және Джексон, СП. «ДНҚ-ның гомомологиялық емес қосылу факторларының теломера ұзындығына және сүтқоректілер жасушасындағы хромосомалық тұрақтылыққа әсері». Қазіргі биология 11 (2001) 15: 1192-1196.
- ^ Marcondes, AM., Bair, S., Rabinovitch, PS., Gooley, T., Deeg, HJ., And Risques, R. «МДС-мен ауыратын науқастардың кемік стромасында теломера қысқармайды». Гематология жылнамалары (2009) 88: 623-628.
- ^ Стендер, Х. «PNA-FISH: жұқпалы ауруларды жылдам диагностикалауға арналған ақылды дақ». Молекулалық диагностикадағы сараптамалық шолу (2003)5:649-655
- ^ Бейли, СМ. және Гудвин, Э.Х. «ДНҚ және Теломерлер: бастаулар мен аяқталулар.» Цитогенетикалық және геномдық зерттеулер (2004)104:109-115
- ^ Falconer, E., Chavez, EA., Henderson, A., Poon, SSS., McKinney, S., Brown, L., Huntsman, DG. And Lansdorp, PM. «ДНҚ шаблон тізбектерінің тізбегі бойынша апа-хроматидтерді анықтау. . « Табиғат (2010)463:93-98.
