Pourbaix диаграммасы - Pourbaix diagram

Жылы электрохимия, және, әдетте, ерітінді химиясында, а Pourbaix диаграммасы, сондай-ақ а потенциал / рН диаграммасы, EH–РН диаграммасы немесе а pE / pH диаграммасы, мүмкін термодинамикалық тұрақты фазалардың сызбасы (яғни, at химиялық тепе-теңдік ) сулы электрохимиялық жүйенің. Шекаралар (50% / 50%) басым химиялық түрлер (ерітіндідегі сулы иондар немесе қатты фазалар) арасындағы сызықтармен ұсынылған. Мұндай Pourbaix диаграммасын стандартқа ұқсас оқуға болады фазалық диаграмма осьтердің басқа жиынтығымен. Фазалық диаграммалар сияқты, олар бұған жол бермейді реакция жылдамдығы немесе кинетикалық әсерлер. Потенциал мен рН-дан басқа тепе-теңдік концентрациялары температураға, қысымға және концентрацияға тәуелді болады. Pourbaix диаграммалары көбінесе бөлме температурасында, атмосфералық қысымда және 10 молярлық концентрацияда беріледі−6 және осы параметрлердің кез-келгенін өзгерту басқа схеманы береді.
Диаграммалар аталған Марсель Пурбайкс (1904-1998), Орыс - туылған бельгиялық химик оларды кім ойлап тапты.
Диаграмма

Pourbaix диаграммалары сондай-ақ белгілі EH- екі осьтің таңбалануына байланысты рН диаграммалары. Тік ось белгіленеді EH үшін кернеу әлеуеті қатысты стандартты сутегі электрод (SHE) бойынша есептелген Нернст теңдеуі. «Н» сутекті білдіреді, дегенмен басқа стандарттарды қолдануға болады және олар тек бөлме температурасына арналған.
қайда вольт - жылу кернеуі немесе «Nernst көлбеуі» стандартты температурада және λ = ln (10), сондықтан вольт Көлденең ось белгіленеді рН .лог функциясы үшін+ иондық белсенділік.
Пурбейкс диаграммасындағы сызықтар тепе-теңдік шарттарын, яғни белсенділігі тең болатын жерді сол сызықтың әр жағындағы түрлерге көрсетеді. Сызықтың екі жағында түрдің бір түрі оның орнына басым деп айтылады.[3]
Түзулердің орнын Нернст теңдеуімен сызу үшін тепе-теңдіктегі химиялық түрлердің белсенділігі анықталуы керек. Әдетте түрдің белсенділігі концентрацияға (еритін түрлер үшін) немесе ішінара қысымға (газдар үшін) тең болады. Жүйеде бар барлық түрлер үшін бірдей мәндерді қолдану керек.[3]
Еритін түрлер үшін сызықтар көбінесе 1 М немесе 10 концентрациясына түсіріледі−6 M. Кейде басқа концентрациялар үшін қосымша сызықтар салынады.
Егер диаграмма еріген түр мен газ арасындағы тепе-теңдікті қамтыса, қысым әдетте орнатылады P0 = 1 атм = 101325 Па, стандартты жағдайда сулы ерітіндіден газдың эволюциясы үшін қажетті минималды қысым.[3]
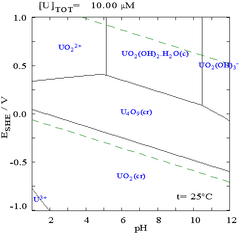
Мұндай сызбаларды кез-келген химиялық жүйеге салуға болатындығына қарамастан, металды байланыстырғыш зат қосылатындығын (лиганд ) диаграмманы жиі өзгертеді. Мысалы, карбонат уранның сызбасына үлкен әсер етеді. (Оң жақтағы сызбаларды қараңыз). Кейбір түрлердің, мысалы, хлорид иондарының микроэлементтерінің болуы, пассивті қабаттарды бұзу арқылы кейбір түрлердің тұрақтылығына үлкен әсер етуі мүмкін.
Сонымен қатар, температурадағы және ерітіндідегі сольвацияланған иондардың концентрациясының өзгеруі тепе-теңдік сызықтарын Нернст теңдеуіне сәйкес жылжытады.
Диаграммалар сонымен қатар кинетикалық эффектілерді ескермейді, яғни тұрақсыз деп көрсетілген түрлер іс жүзінде қандай да бір дәрежеде әрекет етпеуі мүмкін.
Оңайлатылған Пурбайкс диаграммасы тұрақты түрлердің орнына «иммунитет», «коррозия» және «пассивтілік» аймақтарын көрсетеді. Осылайша олар белгілі бір металдың белгілі бір ортадағы тұрақтылығына нұсқау береді. Иммунитет дегеніміз металға шабуыл жасалмайды дегенді білдіреді коррозия жалпы шабуыл болатынын көрсетеді. Пассивтілік металдың беткі қабатында оксидтің немесе басқа тұздың тұрақты жабыны пайда болған кезде пайда болады, бұл ең жақсы мысал - салыстырмалы тұрақтылық алюминий өйткені глинозем ауа әсер еткенде оның бетінде пайда болған қабат.
Пурбайкс диаграммасын есептеу
Металлдан (М) және судан тұратын термодинамикалық жүйенің қарапайым жағдайы үшін әр түрлі реакция теңдеулерін келесі түрде жазуға болады:
қайда р1 және р2 М, сутегі және оттегі қатысатын кез-келген реакторлар. M, H, O және заряд үшін теңдеу теңдестірілген болуы керек. Стандарт Гиббстің бос энергиясы әрбір теңдеумен байланысты. Үшін тепе-теңдік константасын пайдаланып, негіздік-теңдестірілген теңдеуді қышқылдық-тепе-теңдікке айналдыруға болады судың өздігінен иондануы, және төменде тек қышқылмен теңдестірілген теңдеулер қарастырылады.
Келесіде Nernst көлбеуі (немесе жылу кернеуі ) мәні қолданылады, оның мәні 0,02569 ... V в STP. 10-логарифмдер қолданылған кезде, VТ λ = 0,05916 ... V STP кезінде λ= ln [10]. Пурбайкс диаграммасында сызық шекараларының үш түрі бар: тік, көлденең және көлбеу.[4][5]
Тік шекара сызығы
Электрондар алмаспаған кезде (n= 0), арасындағы тепе-теңдік р1 және р2 электродтық потенциалға әсер етпейді, ал шекара сызығы рН мәнімен тік сызық болады. Реакция теңдеуі жазылуы мүмкін:
және энергетикалық баланс келесідей жазылады қайда Қ болып табылады тепе-теңдік константасы: . Осылайша:
немесе 10 базалық логарифмде,
рН-тың белгілі бір мәні үшін шешілуі мүмкін.
Мысалға[4] темір мен су жүйесін және арасындағы тепе-теңдік сызығын қарастырайық темір ион Fe3+ ион және гематит Fe2O3. Реакция теңдеуі:
ол бар .[4] Pourbaix диаграммасындағы тік сызықтың рН мәні келесідей болады:
STP-де, [Fe3+] = 10−6, [Fe2O3] = [H2O] = 1, бұл рН = 1,76 құрайды.
Көлденең шекара сызығы
H кезде+ және OH− иондары қатыспайды, шекара сызығы көлденең, рН-на тәуелсіз. Реакция теңдеуі жазылған:
Энергия тепе-теңдігі
DeG = -F E электродтық потенциалының анықтамасын пайдаланып, оны Нернст теңдеуі ретінде қайта жазуға болады:
немесе 10 базалық логарифмдерді қолдану арқылы:
Темір мен су мысалы үшін Fe арасындағы шекара сызығын қарастырайық2+ және Fe3+ . Реакция теңдеуі:
және электрондар қатысатын болғандықтан, оның Eo = 0,771 В болады[6] және H бастап+ иондар қатыспайды, ол рН-қа тәуелді емес. Температураның функциясы ретінде,
Екі иондық түр үшін де ҒТП-да, және шекарасы көлденең сызық болады Eсағ= 0,771 вольт. Бұл температураға байланысты өзгереді.
Көлбеу шекара сызығы
Бұл жағдайда электрондар да, Н+ иондары қатысады және электродтың потенциалы рН-қа тәуелді. Реакция теңдеуі жазылуы мүмкін:
Потенциалдар бойынша бос энергияның өрнектерін қолдана отырып, энергетикалық баланс Нернст теңдеуімен беріледі:
Темір мен су мысалы үшін Fe темір ионының арасындағы шекара сызығын қарастырайық2+ және гематит Fe2O3. Реакция теңдеуі:
бірге .[4] 10 базалық логарифмде көрсетілген шекара сызығының теңдеуі келесідей болады:
[Fe2O3] = [H2O] = 1 және [Fe2+]=10−6, бұл өнім береді Eсағ= 1.0826 - 0.1775 рН.
Судың тұрақтылық аймағы
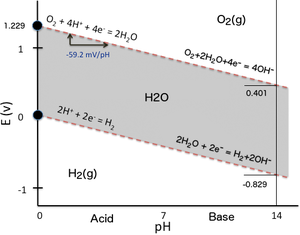
Көптеген жағдайларда жүйеде мүмкін жағдайлар судың тұрақтылық аймағымен шектеледі. Уранға арналған Пурбайкс диаграммасында судың тұрақтылық шегі екі жасыл сызықпен белгіленеді, ал судың тұрақтылық аймағы осы сызықтардың арасына түседі.
Жоғары төмендетілетін жағдайларда (төмен EH/ pE) сәйкесінше су сутегіге дейін азаяды[3]
немесе
Nernst теңдеуін қолдану арқылы E параметрін орнатыңыз0 = 0 V және сутегі газының фугациясы (активтілікке сәйкес) 1, Pourbaix диаграммасындағы судың төменгі тұрақтылық сызығының теңдеуі болады:
стандартты температура мен қысым кезінде. Осы сызықтан төмен су сутегіге дейін азаяды, ал азайту үшін әлі де су болғанша, бұл сызықтан тыс өту мүмкін емес.
Тиісінше, жоғары тотығу жағдайында (жоғары Э.H/ pE) сәйкесінше су оттегі газына дейін тотықтырылады[3]
Nernst теңдеуін жоғарыда көрсетілгендей, бірақ E көмегімен0 = -ΔG0H2O/ 2F = 1,229 В, кезінде судың жоғарғы тұрақтылық шегін береді
стандартты температура мен қысым кезінде. Осы сызықтан жоғарыда су тотықтырылып, оттегі газын түзеді, ал тотығуға әлі су бар болған жағдайда, бұл сызықтан тыс өту мүмкін емес.
Қолданады
Pourbaix диаграммалары бірнеше қолданыста болады, мысалы, коррозия, геология және қоршаған ортаны зерттеу. Пурбайкс диаграммасын дұрыс қолдану ерітіндіде (немесе сынамада) кездесетін түрлердің табиғатын ғана емес, сонымен қатар реакция механизмін түсінуге көмектеседі.[7]
Экологиялық химия
Pourbaix диаграммалары гидросферадағы химиялық түрлердің химиялық әрекеттерін сипаттау үшін кеңінен қолданылады. Бұл жағдайларда, төмендету әлеуеті орнына pE қолданылады EH.[3] pE - бұл өлшемсіз сан және онымен оңай байланыста болуы мүмкін EH теңдеу бойынша
экологиялық химиядағы pE мәні −12-ден +25-ке дейін, өйткені әлеуеті төмен немесе жоғары болған кезде су сәйкесінше азаяды немесе тотықтырылады. Экологиялық қосымшаларда еріген түрлердің концентрациясы әдетте 10-ға дейінгі мәнге қойылады−2 М және 10−5 Тепе-теңдік сызықтарды құру үшін M.
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ «Батыс Орегон университеті».
- ^ а б . Игнаси Пуигдоменех, Hydra / Medusa химиялық тепе-теңдік туралы мәліметтер базасы және графикалық бағдарламалар (2004) KTH Корольдік Технологиялық Институты, еркін түрде жүктелетін бағдарламалық жасақтама «Мұрағатталған көшірме». Архивтелген түпнұсқа 2007-09-29 ж. Алынған 2007-09-29.CS1 maint: тақырып ретінде мұрағатталған көшірме (сілтеме)
- ^ а б c г. e f ван Лун, Гари; Даффи, Стивен (2011). Экологиялық химия - ғаламдық перспектива (3-ші басылым). Оксфорд университетінің баспасы. 235–248 бб. ISBN 978-0-19-922886-7.
- ^ а б c г. Веринк, Э.Д. Кіші «Пурбайкс диаграммаларын құрудың жеңілдетілген тәртібі» (PDF). Алынған 2017-03-29.
- ^ Копелиович, Димитри. «Pourbaix диаграммалары». SubsTech. Алынған 2017-03-29.
- ^ «Табиғи судағы темір химиясы» (PDF). 1459. Геологиялық зерттеу. 1962. Алынған 2017-03-29.
- ^ Noyhouzer T., Bellemare-Alford D., Payne N., Martineau E. және Mauzeroll J., Гальваникалық жасушалардағы жасырын реакцияларды ашу, Электрокатализ, 2018, дои:10.1007 / s12678-018-0459-1.
- Брукинс, Д., Eh-pH Геохимияға арналған диаграммалар. 1988, Springer-Verlag, ISBN 0-387-18485-6
- Денни А. Джонс, Коррозияның принциптері және алдын-алу, 2-ші басылым, 1996 ж., Пренсис Холл, Жоғарғы седла өзені, NJ. ISBN 0-13-359993-0 50-52 бет
- Пурбайкс, М., Су ерітінділеріндегі электрохимиялық тепе-теңдік атласы. 2d ағылш. Ed. 1974, Хьюстон, Текс .: Коррозия инженерлерінің ұлттық қауымдастығы.
- Такено, Наото (мамыр 2005). Eh-pH диаграммаларының атласы (термодинамикалық мәліметтер базасын салыстыру) (PDF) (Есеп). Цукуба, Ибараки, Жапония: Ұлттық ғылыми-техникалық ғылымдар және технологиялар институты - терең геологиялық орталарды зерттеу орталығы. Алынған 2017-05-16.
Сыртқы сілтемелер
- Марсель Пурбайкс - коррозияға қарсы дәрігерлер
- DoITPoMS оқыту және оқу пакеті - «Нернст теңдеуі және Пурбайкс диаграммасы»
Бағдарламалық жасақтама
- ChemEQL Бастап химиялық тепе-теңдікті есептеуге арналған ақысыз бағдарламалық жасақтама Eawag.
- FactSage Ақпараттық банктің коммерциялық термодинамикалық бағдарламасы веб-қосымша.
- Геохимиктің жұмыс үстелі «Aqueous Solutions» жауапкершілігі шектеулі серіктестігінің геохимиялық модельдеудің коммерциялық бағдарламасы.
- GWB Student Edition Танымал геохимиялық модельдеу бағдарламалық жасақтамасының студенттердің тегін басылымы.
- ГИДРА / МЕДУСА Бастап химиялық тепе-теңдік сызбаларын құруға арналған ақысыз бағдарламалық жасақтама KTH Химия кафедрасы.
- HSC химиясы Бастап коммерциялық термохимиялық есептеу бағдарламасы Outotec Oy.
- PhreePlot Көмегімен геохимиялық учаскелер жасауға арналған ақысыз бағдарлама USGS код PHREEQC.
- Термо-калькуляция Windows Thermo-Calc бағдарламалық жасақтамасынан термодинамикалық есептеулерге арналған коммерциялық бағдарламалық жасақтама.
- Материалдар жобасы Компьютерлік материалдардың қасиеттерінің үлкен базасынан Pourbaix диаграммаларын құра алатын жалпыға қол жетімді веб-сайт NERSC.

![{ displaystyle E _ { text {H}} = E ^ {0} - { frac {V_ {T} lambda} {n}} log { frac {[C] ^ {c} [D] ^ {d}} {[A] ^ {a} [B] ^ {b}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee5e4550e539eb3a29ea4281eb96eb9bc5115bfe)








![{ displaystyle K = [r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2 ! O}}] ^ {c} [{ ce {H +}}] ^ {d}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87adfc0c9e0154a616838c46c049bc55f29b0b78)
![{ displaystyle Delta G ^ { circ} = - RT ln ([r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O}}] ^ {c} [{ ce {H +}}] ^ {d})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6379c0a1205f4e534ff2dece3c377c19b1a91f94)
![{ displaystyle Delta G ^ { circ} = - (RT lambda) , ( log ([r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O }}] ^ {c}) - d , { ce {pH}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc62325717e1f27690ddbf1cb9bf2657ebdc3d7c)


![{ displaystyle { ce {pH}} = { frac {1} {6}} left ({ frac { Delta G ^ { circ}} {RT lambda}} + log left ({ frac {{ ce {[Fe2O3]}}} {{ ce {[Fe ^ {3 +}] ^ 2 [H2O] ^ 3}}}} right) right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed92083e91c693c8205cf35ca48cec5a8f4eb96e)

![{ displaystyle Delta G = Delta G ^ { circ} - (RT) ln [r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O}}] ^ {c}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49573779d6c31dd6dcae88b60beb35e8384fc098)
![{ displaystyle E_ {h} = {E ^ { circ}} + { frac {V_ {T}} {n}} ln ([r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O}}] ^ {c})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fdc8eecdeb1b7458fc95d793cb9e6277f514298)
![{ displaystyle E_ {h} = {E ^ { circ}} + { frac {V_ {T} lambda} {n}} log ([r_ {1}] ^ {a} [r_ {2} ] ^ {b} [{ ce {H2O}}] ^ {c})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dca188b0b051f5e3d0006b46d6e4ef0d93c66dba)

![{ displaystyle E_ {h} = {E ^ { circ}} + V_ {T} lambda log left ({ frac {{ ce {[Fe ^ {2 +}]}}} {{ ce {[Fe ^ {3 +}]}}}} оңға)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8d5c40cc273dbc059e29da9efe26d66944aa5c7)



![{ displaystyle E_ {h} = {E ^ { circ}} + { frac {V_ {T} lambda} {n}} ( log ([r_ {1}] ^ {a} [r_ {2) }] ^ {b} [{ ce {H2O}}] ^ {c}) - d , { ce {pH}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4ede4b68bc1cb439390de991bba0b50c2b4779e)


![{ displaystyle E_ {h} = {E ^ { circ}} - { frac {V_ {T} lambda} {2}} left ( log left ({ frac {{ ce {[Fe ^ {+ 2}] ^ 2 [H2O] ^ 3}}} {{ ce {[Fe2O3]}}}} right) +6 { ce {pH}} right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18a9ef1c99cc5b13ceaf698f773290a079c3988f)





