Миоцит - Myocyte
| Миоцит | |
|---|---|
 Бұлшықет жасушасының және нерв-бұлшықет қосылысының жалпы құрылымы:
| |
| Егжей | |
| Орналасқан жері | Бұлшықет |
| Идентификаторлар | |
| Латын | Миоцит |
| MeSH | D032342 |
| TH | H2.00.05.0.00002 |
| ФМА | 67328 |
| Микроанатомияның анатомиялық терминдері | |
A миоцит (сонымен бірге а бұлшықет жасушасы)[1] түрі болып табылады ұяшық кейбір түрлерінде кездеседі бұлшықет тіні. Миоциттер дамиды миобласттар қалыптастыру бұлшықеттер ретінде белгілі процесте миогенез.[2] Миоциттердің ерекше қасиеттері бар екі мамандандырылған түрі бар: жүрек, және тегіс бұлшықет жасушалар. Екінші жағынан, қаңқа бұлшықеттері морфологиялық бірліктер деп аталады бұлшықет талшықтары.[3] Кардиомиоциттер жүрек камераларын құрайтын және бір орталыққа ие жасушалар ядро.[4] Скелеттік бұлшықет талшықтары денені қолдауға және қозғалтуға көмектеседі және олар аталады синцития – көп ядролы эмбрионның дамуы кезінде жеке миобласттардың бірігуінен пайда болған құрылымдар.[5][6] Тегіс бұлшықет жасушалары сияқты еріксіз қозғалыстарды басқарады перистальтика жиырылу өңеш және асқазан.
Құрылым
Терминология
Бұлшықет жасушаларының ерекше микроқұрылымы әкелді жасуша биологтары мамандандырылған терминологияны құру. Алайда, бұлшықет жасушаларына тән әрбір терминнің жасушалардың басқа түрлеріне қолданылатын терминологияда қолданылатын аналогы бар:
| Бұлшықет жасушасы | Басқа ағзалық жасушалар |
|---|---|
| саркоплазма | цитоплазма |
| саркоплазмалық тор | тегіс эндоплазмалық тор (SER) |
| саркома | митохондрия |
| сарколемма | жасуша қабығы |
The саркоплазма болып табылады цитоплазма бұлшықет талшығының / жасушасының. Саркоплазманың көп бөлігі толтырылған миофибриллалар, олар миофиламенттерден тұратын ұзын ақуыз сымдары. Саркоплазма да тұрады гликоген, глюкоза мономерлерінің полисахариді, ол жасушаны жоғары жаттығулармен энергиямен қамтамасыз етеді және миоглобин, бұлшықет белсенділігі үшін қажет болғанша оттегіні сақтайтын қызыл пигмент.[7]
Миофиламенттердің үш түрі бар:[7]
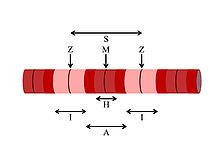
- Ақуыз молекулаларынан тұратын қалың жіпшелер миозин. Бұлшықет жолақтарының созылуында бұл А жолағын құрайтын қара түсті жіпшелер.
- Жіңішке жіпшелер деп аталатын ақуыз молекулаларынан тұрады актин. Бұлшықет жолақтарының созылуында I белдеуін құрайтын жеңіл жіпшелер.
- Серпімді жіпшелерден тұрады титин, үлкен серіппелі ақуыз; бұл жіптер қалың жіптерді Z дискісіне бекітеді.
Бұл миофиламенттер бірге бұлшықеттің жиырылуын тудырады.
The саркоплазмалық тор, мамандандырылған түрі тегіс эндоплазмалық тор, бұлшықет талшығының әр миофибрилінің айналасында тор құрайды. Бұл желі терминалды цистерналар деп аталатын екі кеңейтілген соңғы қапшықтардан және бір көлденең түтікшеден тұрады немесе Т өзекшесі, ол жасуша арқылы тесіліп, екінші жағынан шығады; бірге осы үш компонент саркоплазмалық тордың құрамында болатын үштікті құрайды, онда әр Т түтікшесінде оның екі жағында екі терминалды цистерна болады. Саркоплазмалық тор кальций иондары үшін резервуар қызметін атқарады, сондықтан әсер потенциалы Т түтікшесіне таралғанда саркоплазмалық торға қақпалы мембраналық каналдардан кальций иондарын босату үшін бұлшықеттің жиырылуын ынталандыру үшін сигнал береді.[7][8]
The сарколемма тарихи синонимі болды жасуша қабығы а бұлшық ет талшықтары немесе бұлшықет жасушасы. Сонымен қатар, сарколемманы құрайтын тағы екі компонент бар - базальды ламина және торлы талшықтар. Сарколемманың жасушалық мембранасы тітіркендіргіштерді қабылдайды және өткізеді. Қаңқа бұлшықетінде әр бұлшықет талшығының соңында сарколемманың сыртқы қабаты сіңір талшықтарымен қосылады.[9] Сарколеммаға қарсы басылған бұлшықет талшығының ішінде бірнеше тегістелген ядролар; эмбриологиялық тұрғыдан алғанда, бұл көп ядролық жағдай әр миобласт бір ядроны қосатын әр бұлшықет талшықтарын алу үшін біріктірілген бірнеше миобластардың нәтижесінде пайда болады.[7]
Ішкі

Миоциттің жасушалық мембранасында бірнеше мамандандырылған аймақтар бар, оларға жатады аралық диск және көлденең құбырлы жүйе. Жасуша мембранасын ені шамамен 50 нм ламиналы қабат жабады. Ламинарлық пальто екі қабатқа бөлінеді; The ламина денса және ламина люцида. Осы екі қабат арасында бірнеше иондардың түрлері болуы мүмкін, соның ішінде кальций.[10]
Жасуша мембранасы жасушаға бекітілген цитоскелет ені шамамен 10 нм зәкір талшықтары арқылы. Олар әдетте Z сызықтарында орналасады, сондықтан олар ойықтар мен көлденең түтікшелер пайда болады. Жүрек миоциттерінде бұл қабыршақталған бетті құрайды.[10]
Цитоскелет - бұл жасушаның қалған бөлігі құрастырады және оның екі негізгі мақсаты бар; біріншісі - жасуша ішіндегі компоненттердің рельефін тұрақтандыру, ал екіншісі - жасушаның мөлшері мен формасын басқаруға көмектеседі. Бірінші функция биохимиялық процестер үшін маңызды болса, соңғысы жасушаның беттік және көлемдік қатынасын анықтауда өте маңызды. Бұл қоздырғыш жасушалардың потенциалды электрлік қасиеттеріне қатты әсер етеді. Сонымен қатар, ұяшықтың стандартты пішіні мен өлшемінен ауытқу теріс болжамдық әсер етуі мүмкін.[10]
Миофибриллалар
Әрбір бұлшықет талшықтары бар миофибриллалар, олар өте ұзын тізбектер саркомерлер, жасушаның жиырылатын бірліктері. Ұяшық бихепс брахии бұлшықеті құрамында 80 000 саркомер болуы мүмкін.[11] Миофибриллалары тегіс бұлшықет жасушалар саркомерге орналаспаған. Саркомерлер жұқа және қалың жіпшелерден тұрады. Жіңішке жіптерден жасалған актин және бір-бірімен дұрыс қатар тұруға көмектесетін Z сызықтарына бекітіңіз.[12] Тропониндер жіңішке жіпшелер бойымен аралықта кездеседі. Қалың жіпшелер ұзартылған ақуыздан жасалған миозин.[13] Саркомерада органеллалар немесе ядро болмайды. Саркомерлер саркомердің басы мен соңын көрсететін Z сызықтарымен белгіленеді. Жеке миоциттер қоршалған эндомизиум.
Миоциттер бір-бірімен байланысқан перимизий [[Muscle fascicle] деп аталатын байламдарға; содан кейін шоқтарды біріктіру үшін оларды біріктіру қажет бұлшықет тіні, ол қабықшаға салынған эпимизий. Перимизийде бұлшықет талшықтарын қамтамасыз ететін] тамырлар мен нервтер бар. Бұлшық ет шпиндельдері бұлшықеттерге таралады және сенсорлық кері байланыс туралы ақпарат береді орталық жүйке жүйесі. Миозин ұзын білік тәрізді, оның беті дөңгелектелген ұшымен көрсетілген. Бұл құрылым жіңішке жіпшелермен жалғасатын көлденең көпірді құрайды.[13]
Даму
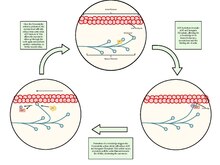
A миобласт эмбрионның бір түрі аталық жасуша бұл ажыратады бұлшықет жасушаларын тудырады.[14] Саралау реттеледі миогендік реттеуші факторлар, оның ішінде MyoD, Myf5, миогенин, және MRF4.[15] GATA4 және GATA6 сонымен қатар миоциттердің дифференциациясында рөл атқарады.[16]
Қаңқа бұлшықет талшықтары миобласттар бірігіп кеткенде жасалады; бұлшықет талшықтары сондықтан жасушалар болып табылады бірнеше ядролар ретінде белгілі мионуклеи, әрқайсысымен жасуша ядросы бір миобласттан шыққан. Миобласттардың бірігуі қаңқа бұлшықетіне тән (мысалы, бицепс брахии ) емес жүрек бұлшықеті немесе тегіс бұлшықет.
Қаңқа бұлшықетіндегі бұлшықет талшықтарын түзбейтін миобластар ажырату қайтадан ішіне миосателлит жасушалары. Бұл спутниктік жасушалар сарколемма мен базальды мембрана арасында орналасқан қаңқа бұлшықет талшығына жақын орналасқан[17] туралы эндомизиум (бұлшықет бұлшықеттерін жеке талшықтарға бөлетін дәнекер тіндік инвестиция). Миогенезді қайта белсендіру үшін жерсерік жасушаларын жаңа талшықтарға дифференциалдау үшін ынталандыру қажет.
Миобласттар мен олардың туындылары, соның ішінде спутниктік жасушалар, in vitro арқылы жасалуы мүмкін бағытталған саралау туралы плурипотентті дің жасушалары.[18]
Киндлин-2 миогенез кезінде дамудың созылуында рөл атқарады.[19]
Бұлшық ет талшығының өсуі
Бұлшық ет талшықтары жаттығу кезінде өседі, ал қолданылмаған кезде кішірейеді. Бұл жаттығулардың жоғарылауын ынталандыратындығына байланысты миофибриллалар бұлшықет жасушаларының жалпы мөлшерін арттыратын. Жақсы жаттығылған бұлшық еттер тек көлем қосып қана қоймай, одан әрі дами алады митохондрия, миоглобин, гликоген және одан жоғары тығыздық капиллярлар. Алайда бұлшықет жасушалары бөлініп, жаңа жасушалар түзе алмайды, нәтижесінде бізде ересек жаста жаңа туған нәрестеге қарағанда бұлшықет жасушалары аз болады.[20]
Функция
Бұлшықеттің жиырылуы
Жұқа және жуан жіпшелер жиырылу кезінде бір-біріне қатысты сырғып қолданады аденозинтрифосфат. Бұл Z дискілерін жылжымалы жіп тәрізді механизм деп аталатын процесте жақындатады. Барлық жиырылу саркомерлер нәтижесінде бұлшықет талшығының толық жиырылуына әкеледі. Миоциттің бұл жиырылуын әрекет әлеуеті үстінен жасуша қабығы миоциттің. Әрекет потенциалы қолданады көлденең түтікшелер жасуша мембранасында үздіксіз болатын миоциттің бетінен ішкі бөлігіне жету үшін.Саркоплазмалық тор - көлденең түтікшелер жанасатын, бірақ бөлек тұрған мембраналық қапшықтар. Олар өздерін әр саркомерге орап, Са-мен толтырылған2+.[13]
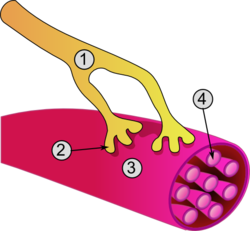
Миоциттің қозуы оның синапстарында деполяризацияны тудырады жүйке-бұлшықет қосылыстары, бұл іске қосады әрекет әлеуеті. Сингулярмен жүйке-бұлшықет қосылысы, әрбір бұлшықет талшықтары тек бір соматикалық эфферентті нейроннан кіріс алады. Әрекет әлеуеті соматикалық эфферентті нейрон нейротрансмиттердің бөлінуін тудырады ацетилхолин.[21]
Ацетилхолин бөлінген кезде ол диффузияланады синапс және рецептормен байланысады сарколемма, жасуша қабығына жататын бұлшықет жасушаларына ғана тән термин. Бұл сарколемма арқылы өтетін импульсты бастайды.[20]
Қашан әрекет әлеуеті саркоплазмалық торға жетеді және ол Са шығарылуын бастайды2+ Ca-дан2+ арналар. Ca2+ саркоплазмалық тордан саркомераға екі жіпшесімен бірге ағады. Бұл жіптердің сырғанауын және саркомерлердің қысқаруын бастайды. Бұл ATP-дің көп мөлшерін қажет етеді, өйткені ол әрқайсысын бекітуде де, босатуда да қолданылады миозин бас. Өте тез Ca2+ қайтадан саркоплазмалық торға белсенді түрде тасымалданады, бұл жіңішке және қалың жіптің өзара әрекеттесуін блоктайды. Бұл өз кезегінде бұлшықет жасушасының босаңсуына әкеледі.[20]
Жиырылу түрлері
Бұлшықеттердің жиырылуының төрт негізгі әр түрлі типтері бар: сілкініс, треппе, сіреспе және изометриялық / изотоникалық. Сығымдаудың жиырылуы - бұл бір тітіркендіргіштің бір жиырылуға сигнал беретін процесі. Сығымдау кезінде жиырылу ұзындығы бұлшықет жасушасының мөлшеріне байланысты өзгеруі мүмкін. Треппе (немесе қосынды) кезінде жиырылу бұлшықеттері максималды тиімділіктен басталмайды; оның орнына олар қайталанған тітіркендіргіштердің арқасында жиырылу күшінің жоғарылауына қол жеткізеді. Сіреспе жылдам қоздырғыштардың әсерінен бұлшықеттердің тұрақты жиырылуын қамтиды, олар бұлшықеттер шаршағанша жалғасуы мүмкін. Изометриялық жиырылу - бұлшықеттің қозғалуын тудырмайтын қаңқа бұлшықетінің жиырылуы. Алайда, изотоникалық жиырылулар - бұл қозғалыс тудыратын қаңқа бұлшықеттерінің жиырылуы.[20]
Мамандандырылған кардиомиоциттер орналасқан синатриальды түйін басқаратын электрлік импульстардың пайда болуына жауап береді жүрек ставка. Бұл электрлік импульстар жүректің қалған бұлшық еттерінде қысылуды жүректің электр өткізгіштік жүйесі. Синоатриальды түйін белсенділігі, өз кезегінде, екі жүйке талшықтарымен модуляцияланады жанашыр және парасимпатикалық жүйке жүйесі. Бұл жүйелер сәйкесінше синоатриялық түйіннің электрлік импульстерінің пайда болу жылдамдығын жоғарылатуға және төмендетуге әсер етеді.
Талшықты теру

Талшықты типтеу үшін көптеген әдістер қолданылады, ал әдістер арасында түсініксіздік мамандар арасында жиі кездеседі. Екі жиі кездесетін әдіс гистохимиялық үшін бояу миозин ATPase белсенділік және иммуногистохимиялық үшін бояу Миозиннің ауыр тізбегі (MHC) түрі. Миозин ATPase белсенділігі әдетте «дұрыс және талшық типі» деп аталады және әртүрлі жағдайларда ATPase белсенділігін тікелей талдау нәтижесінде пайда болады (мысалы, рН ).[22] Миозиннің ауыр тізбегі бояу дәлірек «MHC талшық типі» деп аталады, мысалы. «MHC IIa талшықтары» және әр түрлі MHC анықтау нәтижесінде пайда болады изоформалар.[22] Бұл әдістер физиологиялық тұрғыдан тығыз байланысты, өйткені MHC типі ATPase белсенділігінің негізгі детерминанты болып табылады. Алайда, осы теру әдістерінің ешқайсысы тікелей метаболикалық сипатта емес екеніне назар аударыңыз; олар талшықтың тотығу немесе гликолитикалық қабілетін тікелей шешпейді.
«I типті» немесе «типті II» талшықтарды жалпылама түрде қолданған кезде, бұл миозин ATPase белсенділігінің бояуы бойынша бағаланған сандық талшық типтерінің қосындысын (I-ге қарсы II) дәл айтады (мысалы, «II тип» талшықтар типке жатады) ХАА + тип ХІХ + тип IIXA ... және т.б.).
Төменде адамдарда кездесетін талшық түрлерімен шектелген осы екі әдіс арасындағы байланысты көрсететін кесте берілген. MHC типіне қарсы талшықты типтеу кезінде қолданылатын кіші типтегі капитализацияға назар аударыңыз және кейбір ATPase типтері бірнеше MHC типтерін қамтиды. Сондай-ақ, а В немесе b кіші түрі адамдарда екі тәсілмен де көрінбейді.[23] Ерте зерттеушілер адамдарға MHC IIb экспрессиясын білдіреді деп сенді, бұл IIB-дің ATPase жіктелуіне әкелді. Алайда, кейінгі зерттеулер адамның MHC IIb шын мәнінде IIx екенін көрсетті,[23] IIB-дің IIX-тің жақсырақ екенін көрсетеді. IIb басқа сүтқоректілерде көрінеді, сондықтан әдебиетте дәл (IIB-мен бірге) кездеседі. Адам емес талшықтардың түрлеріне шынайы IIb талшықтары, IIc, IId және т.б. жатады.
| ATPase типі | MHC ауыр тізбегі |
|---|---|
| I тип | MHC Iβ |
| IC түрі | MHC Iβ> MHC IIa |
| IIC типі | MHC IIa> MHC Iβ |
| ХАА теріңіз | MHC IIa |
| IIAX теріңіз | MHC IIa> MHC IIx |
| IIXA түрі | MHC IIx> MHC IIa |
| IIX түрі | MHC IIx |
Одан әрі талшықтарды теру әдістері формальды түрде аз мөлшерде анықталған және спектрдің көп бөлігінде қолданылады. Олар метаболикалық және функционалдық қабілеттерге көбірек көңіл бөледі (яғни, тотығуға қарсы). гликолитикалық, жылдам және баяу жиырылу уақыты). Жоғарыда атап өткендей, ATPase немесе MHC арқылы талшықты теру бұл параметрлерді тікелей өлшемейді немесе оларға нұсқамайды. Алайда, әртүрлі әдістердің көпшілігі механикалық байланысты, ал басқалары өзара байланысты in vivo.[26][27] Мысалы, ATPase талшығының түрі жиырылу жылдамдығымен байланысты, себебі жоғары ATPase белсенділігі тезірек мүмкіндік береді велосипедпен жүру.[22] ATPase белсенділігі жиырылу жылдамдығының бір ғана компоненті болса, I типті талшықтар ішінара «баяу», өйткені оларда II типті талшықтарға қарағанда ATPase белсенділігінің төмен жылдамдығы бар. Алайда, жиырылу жылдамдығын өлшеу ATPase талшығын терумен бірдей емес.
Осы типтегі қатынастарға байланысты I және II типті талшықтар салыстырмалы түрде метаболикалық, жиырылғыш және қозғалтқыш-бірлік қасиеттеріне ие. Төмендегі кестеде қасиеттердің осы түрлері сараланады. Бұл қасиеттер типтері, олар ішінара жеке талшықтардың қасиеттеріне тәуелді болғанымен, сәйкес келеді және деңгейлерінде өлшенеді. қозғалтқыш бөлігі, жеке талшықтан гөрі.[22]
| Қасиеттері | I типті талшықтар | ХАА талшықтарын теріңіз | IIX типті талшықтар |
|---|---|---|---|
| Қозғалтқыш қондырғысының түрі | Баяу тотықтырғыш (SO) | Жылдам тотықтырғыш / гликолитикалық (FOG) | Жылдам гликолитикалық (FG) |
| Бұралу жылдамдығы | Баяу | Жылдам | Жылдам |
| Бұралу күші | Кішкентай | Орташа | Үлкен |
| Шаршауға қарсы тұру | Жоғары | Жоғары | Төмен |
| Гликоген құрамы | Төмен | Жоғары | Жоғары |
| Капиллярлық жабдықтау | Бай | Бай | Кедей |
| Миоглобин | Жоғары | Жоғары | Төмен |
| Қызыл түс | Қараңғы | Қараңғы | Бозғылт |
| Митохондриялық тығыздық | Жоғары | Жоғары | Төмен |
| Капиллярлардың тығыздығы | Жоғары | Аралық | Төмен |
| Тотығу ферментінің сыйымдылығы | Жоғары | Орташа-жоғары | Төмен |
| Z сызығының ені | Аралық | Кең | Тар |
| Сілтілік ATPase белсенділігі | Төмен | Жоғары | Жоғары |
| ATPase қышқылдық белсенділігі | Жоғары | Орташа жоғары | Төмен |
- Талшық түсі
Дәстүрлі түрде талшықтар әр түрлі түске байланысты жіктелді, бұл олардың көрінісі миоглобин мазмұны. I типті талшықтар миоглобиннің жоғары деңгейіне байланысты қызыл болып көрінеді. Қызыл бұлшықет талшықтары митохондрияға және жергілікті капиллярлық тығыздыққа ие болады. Бұл талшықтар төзімділікке көбірек сәйкес келеді және оларды қолданатындықтан баяу шаршайды тотығу метаболизмі ATP генерациялау үшін (аденозинтрифосфат ). Аз типтегі тотығу дәрежесі аз миоглобиннің және гликолитикалық ферменттерге тәуелді болғандықтан ақ түсті.
- Бұралу жылдамдығы
Талшықтарды олардың тез қозғалу қабілеті бойынша жылдам және баяу жиырылу деп жіктеуге болады. Бұл белгілер түстерге, ATPase немесе MHC негізіндегі классификациялармен негізінен, бірақ толықтай сәйкес келмейді.
Кейбір авторлар тез қозғалатын талшықты миозин ATP-ні тез бөле алатын талшық ретінде анықтайды. Оларға негізінен II типті ATPase және MHC II типті талшықтар жатады. Сонымен қатар, тез қозғалатын талшықтар әсер потенциалдарының электрохимиялық берілуінің жоғары мүмкіндігін және саркоплазмалық тормен кальцийдің тез бөлінуі мен сіңірілуін көрсетеді. Шапшаң талшықтар жақсы дамыған, анаэробты, қысқа мерзімді, энергия тасымалдауға арналған гликолитикалық жүйе және баяу талшықтар жылдамдығынан 2-3 есе жиырылып, шиеленісті дамыта алады. Шапшаң бұлшық еттер баяу бұлшықеттерге қарағанда күштің немесе жылдамдықтың қысқа жарылыстарын жасауда әлдеқайда жақсы, сондықтан тез шаршайды.[28]
Баяу талшықтар ұзақ мерзімді жүйенің көмегімен АТФ қайта синтездеу үшін энергия шығарады аэробты энергия беру. Олар негізінен ATPase I типті және MHC I типті талшықтарды қамтиды. Олар ATPase белсенділігінің төмен деңгейіне ие, гликолитикалық қабілеті онша дамымаған жиырылу жылдамдығы баяу. Олардың құрамында митохондрия мөлшері жоғары, миоглобиннің мөлшері қызыл пигментация береді. Олардың митохондриялық ферменттердің жоғары концентрациясы бар екендігі дәлелденді, сондықтан олар шаршағыштыққа төзімді. Баяу бұлшықет бұлшық еттері тез қозғалатын талшықтарға қарағанда баяу өртенеді, бірақ шаршағанға дейін ұзақ уақыт жиырыла алады.[28]
- Түрдің таралуы
Жеке бұлшықеттер әр түрлі талшық типтерінің қоспасы болуға бейім, бірақ олардың үлесі сол бұлшықет пен түрдің әрекеттеріне байланысты өзгеріп отырады. Мысалы, адамдарда квадрицепс бұлшықеттерінде ~ 52% I типті талшықтар болады, ал табанында ~ 80% I тип болады.[29] Көздің orbicularis oculi бұлшық еті тек ~ 15% I типті құрайды.[29] Қозғалтқыш қондырғылары бұлшықет ішінде, алайда, бұл бөлімнің талшықтары арасында минималды өзгеріс болады. Дәл осы факт өлшемді негізгі етеді мотор бөлімдерін жалдау өміршең.
Қаңқа бұлшық ет талшықтарының жалпы саны дәстүрлі түрде өзгермейді деп саналады, талшықтардың таралуында жынысы мен жас ерекшеліктері жоқ деп санайды; дегенмен, талшық түрлерінің пропорциясы бұлшықеттен бұлшықетке және адамнан адамға айтарлықтай өзгереді.
Отырықшы ерлер мен әйелдердің (сонымен қатар жас балалардың) 45% II типті және 55% I типті талшықтары бар.[дәйексөз қажет ]Кез-келген спорттың жоғарғы сатысында тұратын адамдар талшықтардың таралу заңдылықтарын көрсетуге бейім, мысалы шыдамдылыққа ие спортшылар I типті талшықтардың жоғары деңгейін көрсетеді, ал спринттік спортшылар IIX типті талшықтардың көп мөлшерін қажет етеді.Орта қашықтықтағы спортшылар екі түрдің тең таралуын көрсетеді. Бұл көбінесе лақтырушылар мен секірушілер сияқты күш спортшыларына тән, жаттығулардың әр түрлі түрлері қаңқа бұлшық еттерінің талшықтарының өзгеруіне әкелуі мүмкін.[30]
Егер сіз ұзақ уақыт бойы төзімділік түріндегі оқиғаларды жасасаңыз, IIX типті талшықтардың бір бөлігі ХАА типіне айналады деп ойлайды. Алайда, бұл мәселе бойынша бірыңғай пікір жоқ, мүмкін, IIX типті талшықтар жоғары қарқындылыққа төзімділік жаттығуларынан кейін тотығу қабілетінің жоғарылауын көрсетуі мүмкін, бұл оларды тотығу метаболизмін баяу тітіркендіргіш сияқты тиімді жүргізе алатын деңгейге жеткізеді. оқытылмаған пәндердің талшықтары. Бұл митохондрия мөлшері мен санының ұлғаюы және соған байланысты өзгерістер, талшық түрінің өзгеруі емес.
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ ал.], кеңесшілер Даниэль Альберт ... [et (2012). Дорландтың иллюстрацияланған медициналық сөздігі (32-ші басылым). Филадельфия, Пенсильвания: Сондерс / Эльзевье. б. 321. ISBN 978-1-4160-6257-8.
- ^ Миоциттер АҚШ ұлттық медицина кітапханасында Медициналық тақырып айдарлары (MeSH)
- ^ ал.], кеңесшілер Даниэль Альберт ... [et (2012). Дорландтың иллюстрацияланған медициналық сөздігі (32-ші басылым). Филадельфия, Пенсильвания: Сондерс / Эльзевье. 321 және 697 беттер. ISBN 978-1-4160-6257-8.
- ^ «Бұлшық ет ұлпалары». Архивтелген түпнұсқа 2015 жылғы 13 қазанда. Алынған 29 қыркүйек 2015.
- ^ Скотт, В; Стивенс, Дж; Binder-Macleod, SA (2001). «Адамның қаңқа бұлшық ет талшықтарының типтік классификациясы». Физикалық терапия. 81 (11): 1810–1816. дои:10.1093 / ptj / 81.11.1810 ж. PMID 11694174. Архивтелген түпнұсқа 2015 жылғы 13 ақпанда.
- ^ «Неліктен қаңқа бұлшық ет талшықтарында перифериялық ядролар бар екенін біреу біледі, бірақ кардиомиоциттер жоқ? Функционалды артықшылықтары қандай?». Мұрағатталды түпнұсқадан 2017 жылғы 19 қыркүйекте.
- ^ а б c г. Саладин, К (2012). Анатомия және физиология: форма мен қызметтің бірлігі (6-шы басылым). Нью-Йорк: МакГрав-Хилл. 403–405 беттер. ISBN 978-0-07-337825-1.
- ^ Суги, Харуо; Абэ, Т; Кобаяши, Т; Чаен, С; Охнуки, Ю; Саеки, У; Сугиура, С; Герреро-Эрнандес, Агустин (2013). «Иондық күші төмен терінің қоян psoas бұлшық ет талшықтарында жеке миозин бастары тудыратын күштің күшеюі». PLOS ONE. 8 (5): e63658. Бибкод:2013PLoSO ... 863658S. дои:10.1371 / journal.pone.0063658. PMC 3655179. PMID 23691080.
- ^ Бентцингер, КФ; Ванг, YX; Руднички, MA (1 ақпан 2012). «Құрылыс бұлшықеті: миогенездің молекулалық реттелуі». Биологиядағы суық көктем айлағының болашағы. 4 (2): a008342. дои:10.1101 / cshperspect.a008342. PMC 3281568. PMID 22300977.
- ^ а б c Феррари, Роберто. «Сау және миоциттерге қарсы: метаболизм, құрылымы және қызметі» (PDF). oxfordjournals.org/kz. Оксфорд университетінің баспасы. Мұрағатталды (PDF) түпнұсқадан 2015 жылғы 19 ақпанда. Алынған 12 ақпан 2015.
- ^ Такизава, Петр. «Бұлшықет және жүйке-бұлшықет қосылысы» (PDF). Йель университеті.
- ^ Тамаркин, Таң. «Миофибрилдің құрамы». www.stcc.edu/faculty/webpages.asp. STCC Foundation баспасы. Архивтелген түпнұсқа 8 қыркүйекте 2006 ж. Алынған 12 ақпан 2015.
- ^ а б c «Қаңқа бұлшықеттерінің құрылымы және қызметі». курстар. Вашингтон.еду. Мұрағатталды түпнұсқадан 2015 жылғы 15 ақпанда. Алынған 13 ақпан 2015.
- ^ 395 бет, Биология, Бесінші басылым, Кэмпбелл, 1999
- ^ Перри Р, Рудник М (2000). «Миогендік детерминация мен дифференциацияны реттейтін молекулалық механизмдер». Front Biosci. 5: D750–67. дои:10.2741 / Перри. PMID 10966875.
- ^ Чжао Р, Ватт AJ, Battle MA, Ли Дж, Бондоу BJ, Дункан SA (мамыр 2008). «GATA4 және GATA6 екеуінің де жоғалуы жүрек миоциттерінің дифференциациясын блоктайды және тышқандарда акардия пайда болады». Dev. Биол. 317 (2): 614–9. дои:10.1016 / j.ydbio.2008.03.013. PMC 2423416. PMID 18400219.
- ^ Заммит, PS; Кекілік, ТА; Yablonka-Reuveni, Z (қараша 2006). «Қаңқа бұлшықет серігі жасушасы: суықтан келген бағаналы жасуша». Гистохимия және цитохимия журналы. 54 (11): 1177–91. дои:10.1369 / jhc.6r6995.2006. PMID 16899758.
- ^ Chal J, Oginuma M, Al Tanoury Z, Gobert B, Sumara O, Hick A, Bousson F, Zidouni Y, Mursch C, Moncuquet P, Tassy O, Vincent S, Miyanari A, Bera A, Garnier JM, Guevara G, Hestin М, Кеннеди Л, Хаяши С, Дрейтон Б, Черриер Т, Гайро-Морель Б, Гуссони Е, Релайкс Ф, Таджбахш С, Порки О (тамыз 2015). «Дюшеннің бұлшықет дистрофиясын модельдеу үшін плурипотентті дің жасушаларын бұлшықет талшығына дифференциациялау». Табиғи биотехнология. 33 (9): 962–9. дои:10.1038 / nbt.3297. PMID 26237517. S2CID 21241434.

- ^ Доулинг Дж., Вреде А.П., Ким С, Голден Дж, Фельдман Э.Л. (2008). «Kindlin-2 миоциттердің созылуы үшін қажет және миогенез үшін өте маңызды». BMC Cell Biol. 9: 36. дои:10.1186/1471-2121-9-36. PMC 2478659. PMID 18611274.
- ^ а б c г. Зизер, Стивен. «Бұлшықет жасушаларының анатомиясы және қызметі» (PDF). www.austincc.edu. Мұрағатталды (PDF) түпнұсқадан 2015 жылғы 23 қыркүйекте. Алынған 12 ақпан 2015.
- ^ «Бұлшық ет талшықтарының қозуы». курстар. Вашингтон.еду. Вашингтон университеті. Мұрағатталды түпнұсқадан 2015 жылғы 27 ақпанда. Алынған 11 ақпан 2015.
- ^ а б c г. e f MacIntosh, Брайан Р .; Гардинер, Филлип Ф.; МакКомас, Алан Дж. (2006). Скелеттік бұлшықет: формасы және қызметі. Адам кинетикасы. ISBN 978-0-7360-4517-9.
- ^ а б Смерду, V .; Карш-Мизрачи, мен; Чемпион, М; Лейнванд, Л; Schiaffino, S (желтоқсан 1994). «IIx типті миозиннің ауыр тізбегінің транскрипциясы адамның қаңқа бұлшықетінің IIb типті талшықтарында көрсетілген». Американдық физиология журналы. 267 (6 Pt 1): C1723-8. дои:10.1152 / ajpcell.1994.267.6.C1723. PMID 7545970.
- ^ Пит, Д; Старон, RS (15 қыркүйек 2000). «Миозин изоформалары, бұлшықет талшықтарының түрлері және өтпелері». Микроскопиялық зерттеу және әдістеме. 50 (6): 500–9. дои:10.1002 / 1097-0029 (20000915) 50: 6 <500 :: AID-JEMT7> 3.0.CO; 2-7. PMID 10998639.
- ^ Старон, Роберт С .; Джонсон, Питер (қараша 1993). «Ересек адамның қаңқа бұлшықетіндегі миозиндік полиморфизм және дифференциалды көрініс». Салыстырмалы биохимия және физиология B. 106 (3): 463–475. дои:10.1016 / 0305-0491 (93) 90120-T. PMID 8281747.
- ^ Бухтал, Ф .; Шмалбрух, Х. (тамыз 1970). «Адамның бүлінбеген бұлшықетіндегі жиырылу уақыты және талшық түрлері». Acta Physiologica Scandinavica. 79 (4): 435–452. дои:10.1111 / j.1748-1716.1970.tb04744.x. PMID 5472111.
- ^ Гарнетт, Р.А .; О'Донован, М.Дж .; Стефенс, Дж .; Тейлор, А. (ақпан 1979). «Адамның медиальді гастроцнемиясының қозғалтқышын ұйымдастыру». Физиология журналы. 287 (1): 33–43. дои:10.1113 / jphysiol.1979.sp012643. PMC 1281479. PMID 430414.[тұрақты өлі сілтеме ]
- ^ а б «Бұлшық ет талшығының түрі». About.com. Спорттық медицина. Мұрағатталды түпнұсқадан 2007 жылғы 21 қарашада. Алынған 27 қараша 2007.
- ^ а б Джонсон, М.А .; Полгар Дж .; Салмақшы, Д .; Эпплтон, Д. (1973). «Адамның отыз алты бұлшықетіндегі талшық түрлерінің таралуы туралы мәліметтер. Аутопсияны зерттеу». Неврологиялық ғылымдар журналы. 18 (1): 111–129. дои:10.1016 / 0022-510х (73) 90023-3. PMID 4120482.
- ^ Майкл Есис (2006). Жақсырақ спортшы жасаңыз. Соңғы спортшылар туралы тұжырымдамалар. ISBN 978-1-930546-78-3.
Сыртқы сілтемелер
 Қатысты медиа Миоциттер Wikimedia Commons сайтында
Қатысты медиа Миоциттер Wikimedia Commons сайтында- Бұлшықет жасушасының құрылымы