KcsA калий өзегі - KcsA potassium channel
KcsA (Қ вHannel of стрептомиялар A) прокариоттық болып табылады калий өзегі топырақ бактерияларынан Streptomyces lividans кең зерттелген иондық канал зерттеу. The рН[1] белсенді белок екіге ие трансмембраналық сегменттер және өте таңдамалы кеуекті аймақ, K-нің қақпағы мен ысырылуына жауап береді+ иондар жасушадан шығады.[2] KcsA селективті сүзгісінде кездесетін аминқышқылдарының тізбегі прокариоттық және эукариоттық K арасында жоғары деңгейде сақталған+ кернеу арналары;[1][3] Нәтижесінде KcsA бойынша зерттеулер K үшін молекулалық негізде маңызды құрылымдық және механикалық түсінік берді+ иондарды таңдау және өткізу. Бүгінгі күнге дейін ең көп зерттелген иондық арналардың бірі ретінде KcsA - бұл К-ге арналған зерттеу үлгісі+ арнаның қызметі және оның түсіндірілген құрылымы прокариоттық және эукариоттық түрлер үшін арналар динамикасын есептеу модельдеу негізінде жатыр.[4]
| KcsA калий арнасы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
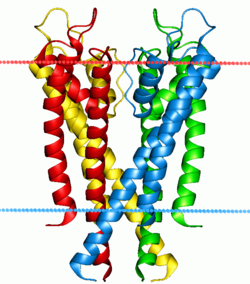 Арнаны құрайтын төрт суббірлік әртүрлі түстермен салынған. Олар суб-бөлімшелердің әрқайсысының P-ілмектерінен тұратын селективті сүзгіден қорғалған орталық тесікті қоршайды. Көк және қызыл нүктелер шекараларын көрсетеді липидті қабат. | |||||||||
| Идентификаторлар | |||||||||
| Таңба | KcsA | ||||||||
| Pfam | PF07885 | ||||||||
| InterPro | IPR013099 | ||||||||
| SCOP2 | 1bl8 / Ауқымы / SUPFAM | ||||||||
| OPM суперотбасы | 8 | ||||||||
| OPM ақуызы | 1r3j | ||||||||
| |||||||||
Тарих
KcsA калий ионының алғашқы каналы болды рентгендік кристаллография арқылы Родерик Маккиннон және оның әріптестері 1998 ж. осыған дейінгі жылдарда К.+ каналдардың қалдықтары арасында кеуектер мен селективтілік сүзгісінің орналасуын анықтауға арналған кішігірім токсинді байланыстыруға бағытталған. МакКиннон тобы теорияны негіздеді тетрамерикалық орналасуы трансмембраналық сегменттері, және тіпті өзара әрекеттесетін аминқышқылдарының қысқа сегменттерінен жасалған сүзгі аймағында тесік түзетін «ілмектердің» болуы Қ+ иондар арнадан өту[5] Күшті дәйектіліктің ашылуы гомология KcsA және Kv отбасындағы басқа арналар арасында, соның ішінде Шейкер ақуыз, ғылыми қауымдастықтың назарын, әсіресе К.+ арналық қолтаңбалардың тізбегі басқаларында пайда бола бастады прокариоттық гендер. KcsA-дағы екі трансмембраналық спиральдың қарапайымдылығы, алтаудағыдан алтауына қарағанда эукариоттық иондық каналдар, сонымен қатар К механизмдерін түсіну әдісін ұсынды+ арналарды неғұрлым қарапайым деңгейде өткізеді, осылайша KcsA-ны зерттеуге үлкен серпін береді.
KcsA-дің кристалды құрылымын 1998 жылы МакКиннон тобы шешкен C терминалы жергілікті ақуыздың цитоплазмалық домені (қалдықтар 126-158) кристалданған сынамалардың тұрақтылығын арттырады. 3.2A ажыратымдылығы бойынша KcsA моделі шығарылды, ол ақуыздың орталық тесік айналасында тетрамериялық орналасуын растады, әр суббірліктің бір спиралы ішкі оське, ал екіншісі сыртқа қарайды.[6] Үш жылдан кейін Морайс-Кабрал және Чжоу шығарғаннан кейін жоғары ажыратымдылықтағы модель шығарылды моноклонды Fab каналды одан әрі тұрақтандыру үшін фрагменттері KcsA кристалдарына бекітілді.[7] 2000 жылдардың басында селективті сүзгіні екі К.+ Кеуекті аймақты модельдеу үшін жасалған энергетикалық және электростатикалық есептеулерге сүйене отырып, тасымалдау процесінде атом пайда болды. Сияқты бейнелеу әдістерімен басқа ашылған және жабық, белсенді емес және белсенді сәйкестіктерді зерттеуді жалғастыру ssNMR және EPR содан бері арнаның құрылымы мен каналды инактивациядан өткізгішке ауыстыратын күштер туралы көбірек түсінік берді.
2007 жылы Риек және т.б. Al. нәтижесінде пайда болатын арнаның ашылуын көрсетті титрлеу рН 7-ден рН 4-ке дейінгі иондық канал, екі аймақтағы конформациялық өзгерістерге сәйкес келеді: селективті сүзгінің ион алмасу күйіне көшу және ТМ2 орналасуының ашылуы C терминалы.[8] Бұл модель KcsA үшін бір уақытта таңдау мүмкіндігін түсіндіреді Қ+ иондар сонымен қатар электр өткізгіштігі. 2011 жылы толық ұзындықтағы KcsA кристалды құрылымы бұрын кесілген қалдықтармен кедергі ақуыздың жасушааралық иондық өту аймағын тек кеңейтуге мүмкіндік беретіндігін анықтады. Бұл зерттеу ион өткізгіштігі кезінде жекелеген арналар аймақтарының қозғалысын егжей-тегжейлі қарастыруға мүмкіндік береді.[9] Қазіргі уақытта KcsA зерттеулері прокариоттық каналды үлкен эукариоттық K арнасының динамикасының үлгісі ретінде қолдануға бағытталған.+ арналар, оның ішінде HERG.
Құрылым

KcsA құрылымы төңкерілген конус, ортасында екі трансмембранадан тұратын орталық тесік бар спираль (сыртқы спираль M1 және ішкі спираль M2), олар созылады липидті қабат. Арнаның өзі тетрамер төрт бірдей, бір-доменді суббірліктерден тұрады (әрқайсысында екі α-спиралы бар), бір М2 спираль орталық тесікке, ал екіншісі М1 спираль орталыққа қарайтындай етіп орналастырылған. липидті мембрана. Ішкі спиральдар қатысты 25 ° көлбеу липидті мембрана және сәл иіліп, жасушаның сыртқы жағына гүл тәрізді ашылады.[6] Бұл екі ТМ спиральдары орталыққа сәйкес келетін жалпы осьтің айналасында симметриялы түрде таралған қайта оралатын циклмен байланысқан тері тесігі. Кеуекті аймақ шамамен 30 аминқышқылының қалдықтарын қамтиды және оны үш бөлікке бөлуге болады: жасушадан тыс жаққа жақын селективті сүзгі, кеңейтілген сумен толтырылған қуыс ортасында және цитоплазмалық жақта орналасқан төрт жабық қақпа М2 тікұшақтарынан құралған.[6] Бұл архитектура калийде жоғары деңгейде сақталған арна отбасы[10][11] екеуінде де эукариоттар және прокариоттар.
Кеуектің жалпы ұзындығы 45 Å, ал оның диаметрі ішкі туннельдің нақты аймақтарында айтарлықтай өзгереді. Бастап саяхаттау жасушаішілік аймақ сыртқа (суретте төменнен жоғары) тері тесігі диаметрі 18 at болатын М2 спиралдарынан пайда болған қақпа аймағынан басталады, содан кейін мембрананың ортасына жақын кең қуысқа (көлденеңінен -10 Å) ашылады.[6] Осы аймақтарда Қ+ иондары қоршаған су молекулаларымен жанасады, бірақ олар каналға жоғарғы жағындағы селективтік сүзгіден кіргенде, қуыс соншалықты тар, K+ Иондар жасушаға ену үшін кез-келген ылғалдандыратын суды төгуі керек.[6] Қатысты амин қышқылы KcsA ішіндегі кеуекті қабаттардың құрамы, ішкі кеуекті және қуысты қаптайтын бүйір тізбектер басым гидрофобты, бірақ таңдамалы сүзгінің ішінде полярлы сусыздандырылған К-мен жанасатын аминқышқылдары бар+ иондар.
Таңдау сүзгісі
Конустың кең ұшы сәйкес келеді жасушадан тыс арнаның сағасы тесік спиралдан тұрады, плюс а селективті сүзгі қалыптасады TVGYG калий арналарына тән реттілік, (треонин, валин, глицин, тирозин, глицин).[12] Осы аймақта TVGYG аминқышқылдары мен келіп түсетін K арасындағы үйлестіру+ иондар канал арқылы иондарды өткізуге мүмкіндік береді. KcsA селективті сүзгісі төрт ионды байланыстыратын орынды қамтиды, дегенмен бұл төрт позицияның тек екеуі бір уақытта орналасуы керек. Сүзгіштің диаметрі шамамен 3 is.[13] дегенмен молекулалық динамика модельдеу сүзгінің икемді екендігін көрсетеді.[14] KcsA сүзгі аймағында TVGYG болуы тіпті күрделі эукариоттық каналдарда сақталады, осылайша KcsA-ны K зерттеудің оңтайлы жүйесі етеді.+ түрлер бойынша каналды өткізгіштік.
Функция

KcsA арнасы модель болып саналады арна өйткені KcsA құрылымы K-ді түсінуге негіз береді+ үш бөліктен тұратын арналық өткізгіштік: Калий селективтілік, рН сезімталдығы бойынша каналдың өтуі және кернеудің арнасын инактивациялау. Қ+ ион өткізгіштік кеуектің жоғарғы таңдамалы сүзгі аймағында пайда болады, ал рН шегі бастап көтеріледі протонация туралы трансмембраналық тесіктің соңында спираль. РН төмен болған кезде М2 спиралы протонданады, иондық арнаны жабықтан ашық конформацияға ауыстырады.[15] Иондар канал арқылы ағып жатқанда, кернеуді ысыру механизмдері Glu71 мен Asp80 арасындағы селективті сүзгідегі өзара әрекеттесуді тудырады деп ойлайды, бұл өткізгіш конформацияны тұрақсыздандырады және ұзаққа созылатын өткізгіш емес күйге енуді жеңілдетеді, бұл C типіне - инактивация кернеуге тәуелді арналар.[16]
РН 7, K болғандағы KcsA өткізбейтін конформациясында+ селективті сүзгі мен төрт TM2 координациялық оксигендерімен тығыз байланысты спираль жақын орналасқан цитоплазмалық кез келген калий иондарының өтуін тоқтататын түйіспе.[8] PH 4-де, KcsA миллисекундтық шкалалық конформациялық алмасулардан өтеді және М2 тікұшақтарының ашық және жабық конформацияларының арасында өткізгіштік және өтпейтін күйлерде болады.[8] Бұл нақты конформациялық өзгерістер арнаның жекелеген аймақтарында болғанымен, әр аймақтың молекулалық әрекеті екеуімен де байланысты электростатикалық өзара әрекеттесу және аллостерия.[8] Фильтрдегі осы алмасу стереохимиялық конфигурациясының динамикасы бір мезгілде K үшін физикалық негіз береді+ өткізгіштік және қақпа.
Қ+селективтілік
TVGYG дәйектілігі, әсіресе, KcsA калий спецификасын сақтау үшін өте маңызды. Бұл селективті сүзгі тізбегіндегі глициндердің сүзгілеудің ақуыз омыртқасындағы карбонилді оттегі атомдарының бір бағытта, кеуектің бойындағы иондарға бағытталуына мүмкіндік беретін екі жақты бұрыштары бар.[5] Глициндер мен треонин К-мен координаталанады+ ион, ал валин мен тирозиннің бүйір тізбектері сүзгіге геометриялық шектеу қою үшін ақуыз өзегіне бағытталған. Нәтижесінде тетрамерде KcsA төрт бірдей қашықтықта орналасқан+ екі жағы кубтың шыңында орналасқан сегіз оттек атомынан құралған тордан тұратын байланыстырушы тораптар. К-ны қоршап тұрған оттегі атомдары+ фильтрдегі иондар гидратталған К-ны қоршап тұрған су молекулалары тәрізді орналасқан+ каналдың қуысындағы иондар; бұл селективті сүзгідегі оттегінің координациясы мен байланысатын жерлері K энергиясының құнын төлейді деп болжайды+ дегидратация.[5] Na + ионы бұл К үшін тым аз болғандықтан+-бөлшектелген байланыс алаңдары, дегидратация энергиясы өтелмейді, осылайша сүзгі басқа иондарды таңдайды.[5] Сонымен қатар, KcsA арнасы бұғатталады Cs+ иондары және қақпа болуын талап етеді Mg2+ иондар.[1]
рН сезімталдығы
KcsA рН-ға тәуелді өткізгіштігі иондық каналдың ашылуы ақуызға қышқыл орта әсер еткенде болатындығын көрсетеді. Riek тобы жүргізген NMR зерттеулері көрсеткендей, рН сезімталдығы ақуыздың C-терминалының TM2 аймағында да, сондай-ақ селективті сүзгідегі Tyr78 және Gly79 қалдықтарында да болады. Негізгі рН датчигі цитоплазмалық доменде деген болжам бар. Теріс зарядталған амин қышқылдарын бейтараптарға ауыстыру трансмембраналық аймақта аминқышқылдық өзгерістер болмағанымен, KcsA арнасын рН-қа сезімталсыз етті.[17][18] Сонымен қатар, рН 6 мен 7 аралығында гистидин - гистидиндердің титрленетін бүйір тізбектерінің бірі; олар TM2 трансмембранасында және жасушадан тыс сегменттерінде жоқ, бірақ KcsA-ның C-терминалында бар. Бұл әсіресе рН-қа сезімтал KcsA-ны баяу ашудың мүмкін механизмін көрсетеді, әсіресе арнаның ашылу сигналының С-терминалынан селективтік сүзгіге конформациялық таралуы бүкіл кеуек бойымен өткізгіштікке қажет құрылымдық өзгерістерді үйлестіруде маңызды болуы мүмкін. .
NMR зерттеулері Tyr78, Gly79, Glu71 және Asp80 арасындағы сутегі байланысының күрделі желісі KcsA сүзгі аймағында бар және одан әрі өткізгіштік үшін рН-сезімтал триггер рөлін атқарады деп болжайды. Аймақтағы негізгі қалдықтардың мутациясы, соның ішінде E71A, 4 ккал мольдің үлкен энергетикалық шығынына әкеледі−1, Glu71 мен Tyr78 арасындағы сутектік байланыстың және Glu71 мен Asp80 арасындағы сутектік байланыстың KcsA (E71A) ішіндегі судың байланысын жоғалтуға тең. Бұл зерттеулер рН қақпасының KcsA арнасының қызметіндегі рөлін одан әрі көрсетеді.
Кернеуді ысыру
2006 жылы Перозо тобы кернеу өрістерінің KcsA қақпасына әсерінің механикалық түсіндірмесін ұсынды. Арнаға деполяризациялайтын ток қосқаннан кейін Glu71-нің жасуша ішілік тесікке бағытталуы орын алады, осылайша бастапқыда селективті сүзгіні тұрақтандыратын Glu71-Asp80 карбоксил-карбоксилат жұбы бұзылады. Сүзгі аймағының құлдырауы инактивацияланған күйге енуді болдырмайды немесе одан шығуды жеңілдетеді.[16] Glu71, K арасында сақталатын таңдамалы сүзгі қолтаңбасының дәйектілігінің негізгі бөлігі+ иондық арналар, қақпада шешуші рөл атқарады, өйткені трансмембраналық кернеу өрісі бағыты бойынша бағытын өзгерту қабілеті KcsA-дағы кернеу есігі оқиғаларына түсініктеме бере алады. Амин қышқылдарының сүзгі аймағындағы бағыты тұрақты күйде эукариоттар мен прокариоттардағы калий ағындарын модуляциялауда маңызды физиологиялық рөл атқаруы мүмкін.[16]
Зерттеу
Функция
Калий арнасын таңдаудың нақты механизмі жалғасуда зерттеп, пікірталас жүргізді және бірнеше модельдер таңдамалылықтың әртүрлі жақтарын сипаттау үшін қолданылады. Джордж Эйзенман жасаған өріс күші тұжырымдамасына негізделген селективтілікті түсіндіретін модельдер[19] негізінде Кулон заңы KcsA-ға қолданылды.[14][20] KcsA селективтілігінің альтернативті түсіндірмесі Benzanilla және жақын арада жасалған модельге негізделген (сонымен қатар ыңғайлы модель деп аталады). Армстронг.[21] The негізгі тізбек селективті сүзгіні құрайтын карбонилді оттегі атомдары дәлме-дәл ұсталып, олардың құрамындағы су молекулаларын алмастыруға мүмкіндік береді. гидратталған қабық туралы калий ион, бірақ олар а-дан тым алыс натрий ион. Әрі қарай жұмыс ион байланысының термодинамикалық айырмашылықтарын зерттеді,[22] топологиялық ойлар,[23][24] және үздіксіз иондармен байланысатын учаскелер саны.[25]
Сонымен қатар, кристалл құрылымын зерттеудің негізгі шектеуі және модельдеу әлі талқыланбаған: KcsA-дің ең жақсы шешілген және қолданылатын кристалды құрылымы арнаның «жабық» формасы сияқты. Бұл ақылға қонымды, өйткені арнаның жабық күйі қолайлы бейтарап рН, ол кезде кристалдық құрылым шешілді Рентгендік кристаллография. Алайда, KcsA динамикалық әрекеті арнаны талдауды қиындатады, өйткені кристалды құрылым міндетті түрде статикалық, кеңістіктік және уақытша орташаланған бейнені ұсынады. Молекулалық құрылым мен физиологиялық мінез-құлық арасындағы алшақтықты жою үшін калий каналдарының атомдық ажыратылымдық динамикасын түсіну қажет.
Қолданбалар
KcsA тесігі мен басқа эукариотты К-дің арасындағы ұқсастықтың жоғары болуына байланысты+ ионды канал ақуыздары, KcsA сияқты кернеуді өткізетін басқа маңызды белоктардың жүрісі туралы маңызды түсінік берді дрозофилла - алынған Шейкер және адам HERG калий өзегі. KcsA қолданылған мутагенез арасындағы өзара әрекеттесуді модельдеуге арналған зерттеулер HERG және әртүрлі дәрілік қосылыстар. Мұндай сынақтар есірткі-hERG арнасының өзара әрекеттесуін тудыруы мүмкін ұзақ QT синдромы, жүрек қызметін анықтау үшін өте қажет қауіпсіздік жаңа дәрі-дәрмектер.[26] Сонымен қатар KCA кристалды жабық күйіне негізделген гомологиялық модельдер HERG жүрек K-нің көптеген күйлерін бейнелеу үшін есептеулермен жасалған.+ арна. Мұндай модельдер hERG арнасының икемділігін ашады және әртүрлі иондық каналдармен өзара әрекеттесетін лигандалар жиынтығының байланыстырушы жақындығын дәйекті түрде болжай алады. Кешенді лиганд-hERG құрылымдарын талдау дәрілік заттардың құрылымы мен қондыру потенциалына негізделген, HERG жауапкершілігі төмендеген дәрілік аналогтардың синтезіне басшылық жасау үшін қолданыла алады.[27]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б в Schrempf H, Schmidt O, Kümmerlen R, Hinnah S, Müller D, Betzler M, Steinkamp T, Wagner R (қараша 1995). «Streptomyces lividans екі болжанған трансмембраналық сегменттері бар прокариотты калий ионының арнасы». EMBO журналы. 14 (21): 5170–8. дои:10.1002 / j.1460-2075.1995.tb00201.x. PMC 394625. PMID 7489706.
- ^ Meuser D, Splitt H, Wagner R, Schrempf H (1999). «Бастап калий арнасының ашық тесігін зерттеу Streptomyces lividans". FEBS хаттары. 462: 447–452. дои:10.1016 / S0014-5793 (99) 01579-3.
- ^ Ю Ф.Х., Яров-Яровой В., Гутман Г.А., Каттералл В.А. (желтоқсан 2005). «Керемет кернеулі иондық каналдағы суперотбасыдағы молекулалық қатынастарға шолу». Фармакологиялық шолулар. 57 (4): 387–95. дои:10.1124 / пр.57.4.13. PMID 16382097.
- ^ Roux B (2005). «K (+) арналарындағы ион өткізгіштік және селективтілік». Биофизика мен биомолекулалық құрылымға жыл сайынғы шолу. 34: 153–71. дои:10.1146 / annurev.biophys.34.040204.144655. PMID 15869387.
- ^ а б в г. Родерик Маккиннон. «Нобель дәрісі: калий каналдары және селективті ион өткізгіштің атомдық негіздері». Nobelprize.org. Nobel Media AB.
- ^ а б в г. e Doyle DA, Morais Cabral J, Pfuetzner RA, Kuo A, Gulbis JM, Cohen SL, Chait BT, MacKinnon R (Сәуір 1998). «Калий арнасының құрылымы: К молекулалық негізі+ өткізгіштік және селективтілік ». Ғылым. 280 (5360): 69–77. Бибкод:1998Sci ... 280 ... 69D. дои:10.1126 / ғылым.280.5360.69. PMID 9525859.
- ^ Чжоу Ю, Морайс-Кабрал Дж.Х., Кауфман А, МакКиннон Р (қараша 2001). «К иондардың координациясы мен гидратациясының химиясы+ арна-Fab кешені 2,0 «рұқсатымен». Табиғат. 414 (6859): 43–8. Бибкод:2001 ж.44 ... 43Z. дои:10.1038/35102009. PMID 11689936.
- ^ а б в г. Baker KA, Tzitzilonis C, Kwiatkowski W, Choe S, Riek R (қараша 2007). «KcsA калий каналының конформациялық динамикасы қақпа қасиеттерін реттейді». Табиғат құрылымы және молекулалық биология. 14 (11): 1089–95. дои:10.1038 / nsmb1311. PMC 3525321. PMID 17922011.
- ^ Uysal S, Cuello LG, Cortes DM, Koide S, Kossiakoff AA, Perozo E (шілде 2011). «KcsA K толық ұзындығындағы активтендіру қақпасының механизмі+ арна ». Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 108 (29): 11896–9. Бибкод:2011PNAS..10811896U. дои:10.1073 / pnas.1105112108. PMC 3141920. PMID 21730186.
- ^ Lu Z, Klem AM, Ramu Y (қазан 2001). «Ион өткізгіштігі калий арналары арасында сақталады». Табиғат. 413 (6858): 809–13. дои:10.1038/35101535. PMID 11677598.
- ^ Choe S (ақпан 2002). «Калий каналының құрылымдары». Табиғи шолулар. Неврология. 3 (2): 115–21. дои:10.1038 / nrn727. PMID 11836519.
- ^ Hille B, Armstrong CM, MacKinnon R (қазан 1999). «Иондық арналар: идеядан шындыққа». Табиғат медицинасы. 5 (10): 1105–9. дои:10.1038/13415. PMID 10502800.
- ^ Hille B (маусым 1973). «Миелинді жүйкедегі калий каналдары. Катиондарға селективті өткізгіштік». Жалпы физиология журналы. 61 (6): 669–86. дои:10.1085 / jgp.61.6.669. PMC 2203488. PMID 4541077.
- ^ а б Носков С.Я., Ру Б (желтоқсан 2006). «Калий каналдарындағы ион селективтілігі». Биофизикалық химия. 124 (3): 279–91. дои:10.1016 / j.bpc.2006.05.033. PMID 16843584.
- ^ Томпсон А.Н., Поссон DJ, Parsa PV, Nimigean CM (мамыр 2008). «KcsA калий каналдарындағы рН сезудің молекулалық механизмі». Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 105 (19): 6900–5. дои:10.1073 / pnas.0800873105. PMC 2383984. PMID 18443286.
- ^ а б в Cordero-Morales JF, Cuello LG, Zhao Y, Jogini V, Cortes DM, Roux B, Perozo E (сәуір 2006). «Калий-каналды селективтілік сүзгісіндегі қақпаның молекулалық детерминанттары». Табиғат құрылымы және молекулалық биология. 13 (4): 311–8. дои:10.1038 / nsmb1069. PMID 16532009.
- ^ Hirano M, Onishi Y, Yanagida T, Ide T (қараша 2011). «РН тәуелді қақпадағы KcsA каналының цитоплазмалық доменінің рөлі». Биофизикалық журнал. 101 (9): 2157–62. Бибкод:2011BpJ ... 101.2157H. дои:10.1016 / j.bpj.2011.09.024. PMC 3207171. PMID 22067153.
- ^ Yuchi Z, Pau VP, Yang DS (желтоқсан 2008). «GCN4 кальций каналының тесік аймағының тұрақтылығын күшейтеді KcsA». FEBS журналы. 275 (24): 6228–36. дои:10.1111 / j.1742-4658.2008.06747.x. PMID 19016844.
- ^ Эйзенман G (1962 ж. Наурыз). «Катионды шыны электродтар және олардың жұмыс режимі». Биофизикалық журнал. 2 (2 Pt 2): 259-323. дои:10.1016 / S0006-3495 (62) 86959-8. PMC 1366487. PMID 13889686.
- ^ Noskov SY, Bernèche S, Roux B (қазан 2004). «Карбонил лигандтарының электростатикалық және динамикалық қасиеттері бойынша калий каналдарындағы иондардың селективтілігін бақылау». Табиғат. 431 (7010): 830–4. Бибкод:2004 ж. 431..830N. дои:10.1038 / табиғат02943. PMID 15483608.
- ^ Bezanilla F, Armstrong CM (қараша 1972). «Кальмар аксондарының калий каналдарына натрий мен цезий иондарының түсуінен болатын теріс өткізгіштік». Жалпы физиология журналы. 60 (5): 588–608. дои:10.1085 / jgp.60.5.588. PMC 2226091. PMID 4644327.
- ^ Варма S, Rempe SB (тамыз 2007). «Таңдау бойынша бөлуге мүмкіндік беретін иондық үйлестіру архитектурасын баптау». Биофизикалық журнал. 93 (4): 1093–9. Бибкод:2007BpJ .... 93.1093V. дои:10.1529 / biophysj.107.107482. PMC 1929028. PMID 17513348.
- ^ Томас М, Джаятилака Д, Корри Б (қазан 2007). «Калий каналын таңдауда координациялық санның рөлі басым». Биофизикалық журнал. 93 (8): 2635–43. Бибкод:2007BpJ .... 93.2635T. дои:10.1529 / biophysj.107.108167. PMC 1989715. PMID 17573427.
- ^ Bostick DL, Brooks CL (мамыр 2007). «K ішіндегі селективтілік+ арналары өткізгіш ионның үйлестірілген күйін топологиялық бақылауға байланысты ». Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 104 (22): 9260–5. Бибкод:2007PNAS..104.9260B. дои:10.1073 / pnas.0700554104. PMC 1890482. PMID 17519335.
- ^ Derebe MG, Sauer DB, Zeng W, Alam A, Shi N, Jiang Y (қаңтар 2011). «Тетрамериялық катионды каналдардың иондық селективтілігін иондармен байланысатын орындар санын өзгерту арқылы реттеу». Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 108 (2): 598–602. Бибкод:2011PNAS..108..598D. дои:10.1073 / pnas.1013636108. PMC 3021048. PMID 21187421.
- ^ Sanguinetti MC, Mitcheson JS (наурыз 2005). «Жүре пайда болған ұзақ QT синдромын тудыратын hERG дәрілік өзара әрекеттесуін болжау». Фармакология ғылымдарының тенденциялары. 26 (3): 119–24. дои:10.1016 / j.tips.2005.01.003. PMID 15749156.
- ^ Раджамани R, Tounge BA, Ли Дж, Рейнольдс Ч (Мар 2005). «HERG-дің екі күйлі гомологиялық моделі+ арна: лигандты байланыстыру ». Биоорганикалық және дәрілік химия хаттары. 15 (6): 1737–41. дои:10.1016 / j.bmcl.2005.01.008. PMID 15745831.
