Галогендік байланыс - Википедия - Halogen bond
A галогендік байланыс арасындағы таза тартымды өзара әрекеттесудің дәлелі болған кезде пайда болады электрофильді байланысты аймақ галоген молекулалық бірліктегі атом және а нуклеофильді басқа, немесе сол, молекулалық бірліктегі аймақ.[1]
Кепілдеу
Сутегі мен галоген байланысын салыстыру:
- Сутектік байланыс
- Галогенді байланыстыру
Екі жағдайда да, А (сутегі / галогендік байланыс акцепторы) - бұл электрондарды кедей H-D немесе X-D түрлеріне электрондарды беретін атом, топ немесе молекула (сәйкесінше сутегі немесе галоген байланысының донорлары). H - сутегі байланысына қатысатын сутегі атомы, ал X - галогендік байланысқа қатысатын галогендік атом. Галогендік байланыстың доноры электронды, ал галогендік байланыс акцепторы электронды қабылдайды.
Параллельді байланыс галоген байланысы мен оңай жүргізілуі мүмкін сутектік байланыс (HB). Жабыстырудың екі түрінде де, ан электронды донор /электрон акцепторы қарым-қатынас бар. Екеуінің арасындағы айырмашылық қандай түр электрондардың доноры / электрон акцепторы бола алатындығында. Сутектік байланыста сутегі атомы электрон акцепторының рөлін атқарады және қабылдау арқылы ковалентті емес өзара әрекеттесуді құрайды электрондардың тығыздығы электронға бай сайттан (электрон доноры). Галогендік байланыста галоген атомы электронды акцептор болып табылады. Бір уақытта H немесе X пен D арасындағы қалыпты ковалентті байланыс әлсірейді, сондықтан H немесе X-дағы электрондардың тығыздығы азаяды. Электрондардың тығыздығы трансферттердің енуіне әкеледі ван дер Ваальс томдар.[2]

Галогенді байланыстыруға қатысатын галогендерге мыналар жатады: йод (I), бром (Br), хлор (Cl), ал кейде фтор (F). Барлық төрт галогендер XB донорлары ретінде әрекет ете алады (теориялық және эксперименттік мәліметтер арқылы дәлелденген) және жалпы тенденцияны ұстанады: F
Дихалогендер (I2, Br2және т.б.) күшті галогендік байланыстар түзуге бейім. Хлор түзілуіндегі хлор мен фтордың күші мен тиімділігі XB донорының табиғатына байланысты. Егер галоген анмен байланысқан болса электронды (электронды алып тастайтын) бөлік, ол галогендік байланыстарды түзуі ықтимал.[4]
Мысалы, йодоферфторалкандар XB үшін жақсы жасалған кристалды инженерия. Сонымен қатар, Ф.2 күшті XB доноры бола алады, бірақ фторкөміртектері әлсіз XB донорлары болып табылады, өйткені алкил Фторға қосылған топ электронды емес. Сонымен қатар, Льюис негізі (XB акцепторы) электронегативті болады, ал аниондар бейтарап молекулаларға қарағанда XB акцепторлары жақсы.
Галогендік байланыстар - бұл нақты, анықталған құрылымдарды тудыратын күшті, спецификалық және бағытталған өзара әрекеттесу. Галогендік байланыстың беріктігі 5-180 кДж / моль аралығында. XB күші HB-мен бәсекелесуге мүмкіндік береді, олар күші жағынан сәл әлсіз. Галогендік байланыс 180 ° бұрышта түзілуге бейім, ол көрсетілген Тақ Хассель 1954 жылы броммен және 1,4-диоксанмен жүргізілген зерттеулер. Галогендік байланыстың беріктігін арттыратын тағы бір фактор галоген (Льюис қышқылы, XB доноры) мен Льюис негізі (XB акцепторы) арасындағы қысқа қашықтықтан туындайды. Галогендік байланыстардың тартымды табиғаты донор мен акцептор арасындағы қашықтық ван-дер-Ваальс радиусының қосындысынан қысқа болатындығына әкеледі. Галоген мен Льюис негізі арасындағы қашықтық азайған сайын XB өзара әрекеттесуі күшейеді.
Тарих
1814 жылы Жан Жак Колин құрғақ газ тәрізді аммиак пен құрғақ йодты араластырғанда сұйықтықтың - металдың жылтырымен пайда болуын сипаттады. Алынған I-нің нақты құрамы2··· NH3 кешенді елу жылдан кейін Фредерик Гутри құрды.[5] Ол өзінің тәжірибесінде мені қосты2 сулы аммиакқа дейін. Молекулалық өзара әрекеттесудің шынайы табиғаты, бірінші жарты жыл бұрын, Роберт Мулликеннің зарядтар мен өзара әрекеттесулер туралы жаңашыл жаңалықтарынан және оларды Од Хассельдің егжей-тегжейлі сипаттауынан кейін ғана түсінікті болды.
1950 жылдары, Роберт С.Мулликен электронды донорлы-акцепторлы кешендердің сыртқы немесе ішкі комплекстерге жатқызылған егжей-тегжейлі теориясын жасады.[6][7][8] Сыртқы кешендер деп электрондар доноры мен акцепторы арасындағы молекулааралық өзара әрекеттесу әлсіз және зарядтың өте аз тасымалданатындығын айтады. Ішкі кешендер зарядтарды қайта бөлудің кең көлеміне ие. Мулликеннің теориясы XB түзілуінің пайда болу механизмін сипаттау үшін қолданылды.
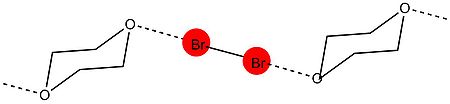
Мулликен өз теориясын дамытқан дәл сол уақытта Хассель жүргізген кристаллографиялық зерттеулер пайда болып, XB түзілуін және оның сипаттамаларын түсінудің бетбұрыс кезеңіне айналды.
Хассель тобынан алғашқы рентгендік кристаллографияны зерттеу 1954 жылы басталды. Эксперимент барысында оның тобы 1,4-диоксанат бромының құрылымын көрсете алды рентгендік дифракция техникасы.[9] Тәжірибе көрсеткендей, диоксан мен бром атомдарының оттек атомдары арасында молекулааралық өзара қысқа әсерлесу болған. Кристалдағы O − Br арақашықтығы 2,71 Ом өлшенді, бұл бром мен оттегі атомдарының өзара әрекеттесуін көрсетеді. Сонымен қатар, арақашықтық оттегі мен бромның ван-дер-Ваальс радиусының қосындысынан аз (3,35 Å). O − Br және Br − Br байланысының бұрышы шамамен 180 ° құрайды. Бұл галогендік байланыстың түзілуіне тән типтік сипаттамалардың алғашқы дәлелі болды және Хассель галоген атомдары электрон жұбы донорындағы жалғыз жұптардың орбитальдарының осьтерімен сәйкес келетін байланыс бағытымен электрон жұбы донорымен тікелей байланысты деген қорытындыға келді. молекула.[10]
1969 жылы галогендердің электрофильді, электронды акцептор ретінде жұмыс істей алатындығын және электрондардың донорларының қатысуымен жоғары бағытта ұйымдастырылған кристалды заряд-тасымалдау кешендеріне өздігінен жинала алатындығын ашқандығы үшін Хассель химия бойынша Нобель сыйлығына ие болды.[11] 1968 жылы Bent электронды донор-акцептор туралы алғашқы шолуды ұсынды.[12] «Галогендік байланыс» терминін 1978 жылға дейін CCl кешендерін зерттеген Дюма мен оның әріптестері жүзеге асырған жоқ.4, CBr4, SiCl4және SiBr4 бірге тетрагидрофуран, тетрагидропиран, пиридин, анизол, және ди-н-бутил эфирі органикалық еріткіштерде[13]
Алайда, 90-жылдардың ортасына дейін ғана галогендік байланыстың табиғаты мен қолданылуы қарқынды түрде зерттеле бастады. Легонның және әріптестерінің жүйелі және ауқымды жұмыстары, олар газ фазасында микротолқынды спектроскопия арқылы түзілген галогенді байланыстырылған қосылғыштардың алуан түрін зерттеді, галогенді және сутектік байланыстыратын өзара әрекеттесулер арасындағы ұқсастықтарға назар аударды.[14] Политцер мен Мюррейдің есептеулері әсіресе маңызды болды, өйткені галогендік байланыстың жоғары бағытталуы галоген ядросы айналасында электрондардың тығыздығының анизотропты үлестірілуінің нәтижесі болып табылады.[15] және «σ-тесік» анықтамасына жол ашты.[16]
Қазіргі уақытта XB көптеген функционалды қолдану үшін пайдаланылуда, мысалы, кристалл инженериясы, молекулярлық химия, полимер туралы ғылымдар, сұйық кристалдар, өткізгіш материалдар және дәрілік химия.[17][18]
Қолданбалар
Бұл бөлім сияқты жазылады жеке рефлексия, жеке эссе немесе дәлелді эссе Википедия редакторының жеке сезімін баяндайтын немесе тақырып туралы түпнұсқа дәлел келтіретін. (Тамыз 2013) (Бұл шаблон хабарламасын қалай және қашан жою керектігін біліп алыңыз) |
Хрустальды инженерия
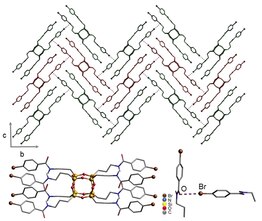
Хрустальды инженерия - қатты дене мен супрамолекулалық химияны құрайтын ғылыми бағыт.[20] Бұл бірегей сала пәнаралық болып табылады және сияқты дәстүрлі пәндерді біріктіреді кристаллография, органикалық химия, және бейорганикалық химия. 1971 жылы Шмидт алғаш рет қатты денеде фотодимеризациялау туралы жарияланыммен өріс ашты.[21] Соңғы анықтамада кристалл инженериясы кристалдану үшін және әртүрлі физикалық-химиялық қасиеттері бар жаңа заттарды жасау үшін молекулааралық өзара әрекеттесуді қолдану ретінде анықталады. Галогендік байланыс ашылғанға дейін кристалды инженерлік тәсіл қолдануды қажет етеді сутектік байланыс, координациялық химия және сұйық-кристалды және қатты кристалды материалдарды жасауға арналған ионаралық өзара әрекеттесу. Сонымен қатар галогенді байланыс радикалды катионды тұздарды ұйымдастыруға, молекулалық өткізгіштерді жасауға және сұйық кристалды құрылымдарды жасауға қолданылады. Галогендік байланыс ашылғаннан бері жаңа молекулалық қосылыстар пайда болды.[22] Галогендік байланыстың ерекше химиялық табиғатына байланысты бұл молекулааралық өзара әрекеттесу кристалл инженериясын дамытудың қосымша құралы ретінде қызмет етеді.[23]
Сұйық кристалл түзілуінде галоген байланысын алғаш рет қолданған Х.Лок Нгуен болды.[24] Сұйық кристаллдарды қалыптастыру мақсатында алкоксилистазолдар мен пентафторииодобензол қолданылды. Алдыңғы зерттеулер Метранголо және Реснати пентафторииодобензолдың қатты күйдегі құрылымдар үшін пайдалылығын көрсетті.[2] Сызықты емес оптика мен металломесогендер үшін әртүрлі алкоксилотилбазолдар қолданылған.[25] Реснатидің тағы бір тұжырымын қолдана отырып (мысалы, N − I кешендері қатты түзіледі), топ иодопентафторбензолмен және 4-алкоксистилбазолдармен галогенмен байланысқан комплекстер құрады. Рентгендік кристаллографияда N − I арақашықтық 2.811 (4) Å және байланыс бұрышы 168.4 ° болатындығы анықталды. Ұқсас N − I арақашықтық қатты ұнтақтармен өлшенді.[26] Ашылған N − I арақашықтық азот пен йод үшін Ван Дер Ваальс радиусының қосындысынан (3,53 Å) қысқа. Молекулалардың бірыңғай кристалды құрылымы квадруполярлы өзара әрекеттесулер болмағанын көрсетті. 4-суреттегі кешендер сұйық-кристалды екендігі анықталды.
Галогендік байланыс күшіне поляризацияның қатысуы туралы ұғымды тексеру үшін Льюис негізі ретінде бромопентафторбензол қолданылды. Демек, галогендік байланыс кешенінің түзілуін тексеру алынған жоқ. Бұл тұжырым галогендік байланыстың атомдық поляризацияға тәуелділігін көбірек қолдайды. Ұқсас донорлық-акцепторлық құрылымдарды қолдана отырып, авторлар сұйық кристалды күйдегі галогендік байланыс күшін сутегімен байланысқан мезогендермен салыстыруға болатындығын көрсетті.
Поли дайындау (диододиацетилен)

Біріктірілген полимерлердің қасиеттерін қолданатын қосымшалар Хигер, Макдиарамид және Ширакава деген жаңалықпен полиацетилен материалды өңдеу қиын болса да, өткізгіш болып табылады. Содан бері осы біріктірілген полимердің омыртқасын (мысалы, поли (р-фениленевинилен)) имитациялау бойынша жұмыс жасалды. Біріктірілген полимерлер көптеген практикалық қосымшаларға ие және сияқты құрылғыларда қолданылады фотоэлементтер, органикалық жарық диодтары, өрісті транзисторлар, және химиялық датчиктер. Горофф және басқалар. мономерді (2) галогендік байланыстыратын тірекпен алдын ала орналастыру арқылы дайындалған поли (диододиацетилен) (PIDA) дайындады.[27] PIDA басқа конъюгацияланған полимерлердің керемет ізашары болып табылады, өйткені йод оңай өзгереді. Мысалы, C − I бөлінуі мүмкін электрохимиялық тотықсыздану.[28]
Хрусталь құрылымдар мономердің (2) құрамы мен байланысы әртүрлі әртүрлі материалдар. Хосттар (3-7) олардың молекулалық орамдары үшін зерттелді, ең алдымен зерттеу арқылы бірлескен кристалдар мономер (2) және тиісті хост. (3) және (4) екеуі де алдын-ала ұйымдастырылған мономер (2), бірақ йодтардың айналасында стерикалық тығыздық мономердің табысты топологиялық полимерленуіне жол бермеді. Хосттар (5-7) пайдаланады сутектік байланыстар және галогендік байланыстар полимеризацияны жеңілдету үшін мономерді (2) бір-бірінен оңтайлы қашықтықта ұстайды.
Шындығында, 7 хост қолданылған кезде, полимеризация қос кристаллдарды бөліп алған кезде өздігінен пайда болды. Хрусталь құрылымдар көрсету полимер жіптер сутегімен байланысатын желіге және иесіне параллель нитрилдер йод атомдарымен галогендік байланысқан Кристалдағы (1) құрамындағы йод атомдарының жартысы оксаламид оттегі атомдарымен тығыз байланыста болады. 7 иесінің оттегі атомдары сутегі де, галогендік байланыс акцепторлары ретінде де әрекет етеді.


Кеуекті құрылымдар

Кеуекті құрылымдар әр түрлі қолданыста болады. Көптеген химиктер және материалтанушы ғалымдар жақсарту үшін жұмыс істейді металлорганикалық жақтаулар (MOF) автомобильдерде пайдалану үшін сутекті сақтауға арналған. Бұл жоғары деңгейде ұйымдастырылған кристалды инклюзия кешендерінің мүмкін қолданылуы бар катализ және молекулалық бөлгіш құрылғылар. Молекулалық ұйым көбінесе арқылы басқарылады молекулааралық күштер сияқты сутектік байланыс. Алайда, пайдалану сутектік байланыс жақын орауышқа байланысты қол жетімді тесіктердің ауқымын жиі шектейді.
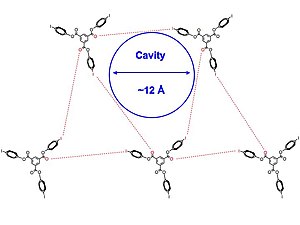
Pigge және басқалар арасындағы галогенді байланыстыруды қолданды аминдер, азот гетероциклдар, карбонил топтар және басқа органикалық галогенидтер, олардың кеуекті құрылымдарын тұрғызу. Бұл өте маңызды, өйткені галогендік байланыстар арқылы жүретін органикалық кристалды желілер, өзара әрекеттесуі сутегі байланысына қарағанда әлдеқайда әлсіз.[29]
Кристалл құрылымдары 1 және 2 [төменде] әртүрлі алынған еріткіштер, сияқты дихлорметан, пиридин, және бензол. Авторлар кеуекті инклюзия кешендерінің ішінара бұрын-соңды болып көрмеген I-π өзара әрекеттесуі және йод пен галогендік байланыс арқылы пайда болатындығын атап өтті. карбонил топтар. The кристалдық құрылым [төменде көрсетілген] үшбұрышты массивке бірігіп, 2 молекулалары шамамен симметриялы болады. Сонымен қатар, галогенді байланыстыратын өзара әрекеттесулердің барлық жиынтығы бірдей емес, ал галоген мен галогендік байланыс акцепторының арасындағы барлық молекулааралық өзара әрекеттесулер жиынтықтың қосындысынан біршама асып түседі. Ван-дер-Ваальс радиусы, құрылымдағы икемділікке әкелетін сәл әлсіз галоген байланысын білдіреді. 2D қабаттары бір-біріне параллель қабаттасып, еріткішпен толтырылған арналар шығарады.
Еріткіштің өзара әрекеттесуі алты қырлы құрылымдардың пайда болуында да байқалады, әсіресе пиридин және хлороформ. Бастапқыда осы ерітінділерді құрайтын кристалдар арналы құрылымдар құрайды. Уақыт өте келе, сольватсыз ине тәрізді жаңа құрылымдар бір-біріне тығыз оралған және бұл инелер термодинамикалық қолайлы кристалл болып табылады. Авторлар осы ақпаратты бірін-бірі толықтыратын табиғатты жақсырақ түсіну үшін қолданамыз деп үміттенеді сутектік байланыстар және кішігірім молекулалардың құрылымын болжау үшін галогендік байланыстар.
Биологиялық макромолекулалардағы галогендік байланыс
Біраз уақыт галогенді биологиялық макромолекулалық құрылыммен байланыстырудың маңызы ескерілмей қалды. Бір кристалды құрылымдарға негізделген ақуыз мәліметтер қоры (PDB) (2004 ж. Шілде айы), Аффингердің және басқалардың 3 Å ажыратымдылығы бар немесе ПДБ-ға жақсырақ енгізілген бір кристалды құрылымдар бойынша жүргізген зерттеуі алты галогенді негіздегі нуклеин қышқылы құрылымында және алпыс алты ақуызда 100-ден астам галогендік байланыс табылғанын анықтады. - галоген мен оттектің өзара әрекеттесуіне арналған субстраттық кешендер. Галоген-оттектің өзара әрекеттесуі сияқты жиі болмаса да, галоген-азот және галоген-күкірт байланыстары анықталды.[30] Бұл ғылыми тұжырымдар галогендік байланыстың биологиялық жүйелердегі рөлін анықтауға ерекше негіз береді.
Био-молекулалық деңгейде галоген байланысының субстраттың ерекшелігі, байланысы және молекулалық бүктелуі үшін маңызы зор.[31] Ақуыз-лигандтың өзара әрекеттесуі жағдайында поляризацияланатын галогендермен зарядты тасымалдаудың ең көп тараған байланыстарына магистральды карбонилдер және / немесе аминқышқылдарының қалдықтарының гидроксил және карбоксилат топтары жатады. Әдетте ДНҚ және ақуыз-лигандтық кешендер, Льюис негізінің донорлық атомдары (мысалы, O, S, N) мен Льюис қышқылы (галоген) арасындағы байланыс қашықтығы олардың Ван-дер-Ваальс радиусының қосындысынан аз. Құрылымдық және химиялық ортаға байланысты галогендік байланыс өзара әрекеттесуі әлсіз немесе күшті болуы мүмкін. Кейбір ақуыз-лигандты кешендер жағдайында галогендік байланыстар энергетикалық және геометриялық тұрғыдан, егер донорлық-акцепторлық бағыт тұрақты болса, сутегімен байланысады. Бұл молекулааралық өзара әрекеттесу тұрақтандырушы және ақуыз-лиганд пен ДНҚ құрылымдарындағы конформациялық детерминант болып шықты.
Молекулалық тану және байланыстыру үшін галоген байланысы маңызды болуы мүмкін. Дәрі-дәрмектерді жобалаудағы осы тұжырымның мысалы ретінде IDD 594-тің адамға байланысуының субстрат ерекшелігі болып табылады альдозды редуктаза.[32] Е.И. Ховард осы мономериялық ферменттің ең жақсы ажыратымдылығы туралы хабарлады. Бұл биологиялық макромолекула 316 қалдықтан тұрады және ол альдозаларды, кортикостероидтар мен альдегидтерді азайтады. D-глюкозаның ферментативті конверсиясының өнімі D-сорбитол қант диабеті патологиясының төменгі әсеріне ықпал етеді деп саналады.[33] Демек, бұл ферментті тежеу терапевтік артықшылыққа ие.
Альдегид негізіндегі және карбоксилат ингибиторлары тиімді, бірақ улы, себебі альдегидредуктазаның функционалдық белсенділігі нашарлайды. Карбоксилат және альдегид ингибиторлардың сутектік байланысы Trp 111, Tyr 48 және His 110-мен көрсетілген. Ингибиторды байланыстыру нәтижесінде пайда болған «спецификалық қалта» Leu 300, Ala 299, Phe 122, Thr 113 және Trp 111-ден тұрады. ингибиторлары тиімді болу үшін, өзара әрекеттесудің негізгі қалдықтары Thr 113 және Trp 111 деп анықталды. IDD 594 галоген селективтілікті қамтамасыз ететін және күшті болатындай етіп жасалған. Байланысты болған кезде бұл қосылыс конформациялық өзгерісті тудырады, бұл Thr оттегі мен ингибитордың бромы арасында галогендік байланыс пайда болады. Байланыс арақашықтығы 2,973 (4) Å-ге тең болды. Дәл осы O-Br галогендік байланысы адамның альдозды редуктаза үшін емес, ингибиторының үлкен күшіне ықпал етеді. альдегид редуктаза.

Әдебиеттер тізімі
- ^ Десижару, Г.Р .; Хо, П.С .; Клоо, Л .; Легон, С .; Маркардт, Р .; Метранголо, П .; Политцер, П .; Реснати, Г .; Риссанен, К. (2013). «Галоген облигациясының анықтамасы (IUPAC ұсыныстары 2013 ж.)». Таза Appl. Хим. 85 (8): 1711–1713. дои:10.1351 / pac-rec-12-05-10.
- ^ а б Метранголо, П .; Реснати, Г. (2001), «Галогендік байланыс: супрамолекулалық химиядағы парадигма», Хим. Еуро. Дж., 7 (12): 2511–2519, дои:10.1002 / 1521-3765 (20010618) 7:12 <2511 :: AID-CHEM25110> 3.0.CO; 2-T, PMID 11465442
- ^ Политцер, П .; т.б. (2007), «Галогенді байланыстыруға шолу», Дж.Мол. Үлгі, 13 (2): 305–311, дои:10.1007 / s00894-006-0154-7, PMID 17013631
- ^ Метранголо, П .; Нойкирх, Н; Пилати, Т; Реснати, Г. (2005), «Галогенді байланыстыру негізінде тану процестері: сутегі байланысына параллель әлем†", Acc. Хим. Res., 38 (5): 386–395, дои:10.1021 / ar0400995, PMID 15895976
- ^ Гутри, Ф. (1863), «Xxviii. - Йодаммоний йодидінде», Дж.Хем. Soc., 16: 239–244, дои:10.1039 / js8631600239
- ^ Мулликен, Р.С. (1950), «Галоген молекулалары хош иісті және оттекті еріткіштермен түзетін кешендердің құрылымы1», Дж. Хим. Soc., 72 (1): 600, дои:10.1021 / ja01157a151
- ^ Мулликен, Р.С. (1952), «Молекулалық қосылыстар және олардың спектрлері. II», Дж. Хим. Soc., 74 (3): 811–824, дои:10.1021 / ja01123a067
- ^ Мулликен, Р.С. (1952), «Молекулалық қосылыстар және олардың спектрлері. III. Электрондар мен акцепторлардың өзара әрекеттесуі», J. физ. Хим., 56 (7): 801–822, дои:10.1021 / j150499a001
- ^ Хассель О .; Хвослеф, Дж .; Виховде, Э. Хадлер; Соренсен, Нильс Андреас (1954), «Бром 1,4-диоксанаттың құрылымы» (PDF), Acta Chem. Жанжал., 8: 873, дои:10.3891 / acta.chem.scand.08-0873
- ^ Хассель, О. (1970), «Атомаралық заряд-трансфер байланысының құрылымдық аспектілері», Ғылым, 170 (3957): 497–502, Бибкод:1970Sci ... 170..497H, дои:10.1126 / ғылым.170.3957.497, PMID 17799698
- ^ Хассель, О. (1972). «Атомаралық заряд-трансферт байланысының құрылымдық аспектілері». Нобель дәрістерінде, химия 1963-1970 жж: 314–329.
- ^ Bent, H. A. (1968). «Донор мен акцепторлардың өзара әрекеттесуінің құрылымдық химиясы». Хим. Аян. 68 (5): 587–648. дои:10.1021 / cr60255a003.
- ^ Дюма, Дж.-М .; Пюрихард, Х .; Гомель, М. (1978). «CX4 ... Базалық өзара әрекеттесу әлсіз заряд-тасымалдаудың өзара әрекеттесуінің моделі ретінде: күшті заряд-тасымалдаумен және сутек-байланыс байланыстарымен салыстыру». Дж.Хем. Рес. (S). 2: 54–57.
- ^ Legon, A. C. (1999). «Газ фазасында Льюис негіздері бар XY диалогендерінің преактивті кешендері: галогендік аналогтың жүйелі жағдайы B ··· XY сутегі байланысы B ··· HX». Angew. Хим. Int. Ред. 38 (18): 2686–2714. дои:10.1002 / (sici) 1521-3773 (19990917) 38:18 <2686 :: aid-anie2686> 3.0.co; 2-6.
- ^ Политцер, П .; Мюррей, Дж. С .; Кларк, Т. (2010). «Галогенді байланыстыру: электростатикалық қозғалысқа келтірілген жоғары бағытталған, ковалентті емес өзара әрекеттесу». Физ. Хим. Хим. Физ. 101: 16789–16794.
- ^ Кларк, Т .; Хеннеманн М .; Мюррей, Дж. ХС .; Политцер, П. (2007). «Галогенді байланыстыру: σ-тесік». Дж.Мол. Үлгі. 13 (2): 291–296. дои:10.1007 / s00894-006-0130-2. PMID 16927107.
- ^ Джилдай, Л. С .; Робинсон, С.В .; Барендт, Т.А .; Лэнгтон, Дж .; Муллани, Б.Р .; Beer, P. D. (2015). «Супрамолекулалық химиядағы галогендік байланыс». Хим. Аян. 115 (15): 7118–7195. дои:10.1021 / cr500674c. PMID 26165273.
- ^ Кавалло, Г .; Метранголо, П .; Милани, Р .; Пилати, Т .; Приимаги, А .; Реснати, Г .; Terraneo, G. (2016). «Галоген облигациясы». Хим. Аян. 116 (4): 2478–2601. дои:10.1021 / acs.chemrev.5b00484. PMC 4768247. PMID 26812185.
- ^ Жанета, Матеуш; Сзаферт, Славомир (2017-10-01). «T-типті амидо-POSS синтезі, сипаттамасы және термиялық қасиеттері p-галофенилдің соңғы тобымен». Органометаллды химия журналы. 847: 173–183. дои:10.1016 / j.jorganchem.2017.05.044. ISSN 0022-328X.
- ^ Брага, Д .; Десираджу, Гаутам Р .; Миллер, Джоэл С .; Орпен, А.Гай; Бағасы, Сара (Салли) Л .; т.б. (2002), «Кристалл инженериясындағы инновация», CrystEngComm, 4 (83): 500–509, дои:10.1039 / b207466b
- ^ Шмидт, Г.М.Ж. (1971), «Қатты күйдегі фотодимерлеу», Таза Appl. Хим., 27 (4): 647–678, дои:10.1351 / pac197127040647
- ^ Метранголо, П .; Реснати, Джузеппе; Пилати, Туллио; Лиантонио, Розалба; Мейер, Франк; т.б. (2007), «Галогенді байланыстыру бойынша инженерлік функционалды материалдар», Дж.Полим. Ғылыми еңбек, А бөлімі: Полим. Хим., 45 (1): 1–14, Бибкод:2007JPoSA..45 .... 1М, дои:10.1002 / пола.21725
- ^ Метранголо, Пьеранжело; Реснати, Джузеппе; Пилати, Туллио; Терранео, Джанкарло; Biella, Serena (2009), «Галогенді байланыстырудағы анионды үйлестіру және анионды шаблондау», CrystEngComm, 11 (7): 1187–1196, дои:10.1039 / B821300C
- ^ Нгуен, Лок; Al, H. et; Херстхаус, МБ; Легон, айнымалы ток; Брюс, DW (2004), «Галогенді байланыстыру: сұйық кристалды түзудің жаңа өзара әрекеттесуі», Дж. Хим. Soc., 126 (1): 16–17, дои:10.1021 / ja036994l, PMID 14709037
- ^ Брюс, Д.В. (2001), «Алкоксилистилбазолдар мен олардың металл кешендерінің материал-химиясы», Adv. Инорг. Хим., Бейорганикалық химияның жетістіктері, 52: 151–204, дои:10.1016 / S0898-8838 (05) 52003-8, ISBN 9780120236527
- ^ Вайнарт, М .; Рауафи, Н .; Джувелет, Б .; Дума, Л .; Боденгаузен, Г .; Бужел, К .; Шоллхорн, Б .; Tekley, P. (2008), «Қатты күйдегі ЯМР спектроскопиясы арқылы ковалентті емес галоген байланысының молекулалық өзін-өзі құрастыруы мен геометриясын ашу», Хим. Коммун. (45), 5981–5983 б., дои:10.1039 / b813237b, PMID 19030559
- ^ Күн, А .; Лаухер, Дж .; Горофф, Н.С. (2006), «Көміртек пен йодтың тапсырыс бойынша біріктірілген полимерін (диододиацетилен) дайындау», Ғылым, 312 (5776): 1030–1034, Бибкод:2006Sci ... 312.1030S, дои:10.1126 / ғылым.1124621, PMID 16709780
- ^ Күн, А .; Лаухер, Дж .; Горофф, Н.С. (2008), «Көміртек пен йодтың реттелген біріктірілген полимерін (диододиацетилен) дайындау», Ғылым, 312 (5776): 1030–1034, Бибкод:2006Sci ... 312.1030S, дои:10.1126 / ғылым.1124621, PMID 16709780
- ^ Шошқа, Ф .; Вангала, V .; Кападия, П .; Суенсон, Д .; Рэт, Н .; Хим, Комм (2008), «4-йодофеноксия тримсоатының алтыбұрышты кристалды қосынды кешендері», Химиялық байланыс, 38 (39): 4726–4728, дои:10.1039 / b809592b, PMID 18830473
- ^ Афингер, П .; Хейс, ФА; Westhof, E; Хо, PS; т.б. (2004), «Биологиялық молекулалардағы галогендік байланыстар», Proc. Натл. Акад. Ғылыми. АҚШ., 101 (48): 16789–16794, Бибкод:2004PNAS..10116789A, дои:10.1073 / pnas.0407607101, PMC 529416, PMID 15557000
- ^ Штейнрауф, Л.К .; Хэмилтон, Дж .; Брэден, BC; Муррелл, Дж .; Бенсон, медицина; т.б. (1993), «Ала-109 рентгендік кристалды құрылымы - эутиреоидты гипертироксинемия түзетін адамның транстриретинінің Thr варианты», Дж.Биол. Хим., 268 (4): 2425–2430, PMID 8428916
- ^ Ховард, Э.И .; т.б. (2004), «Ультра жоғары резолюциялы дәрі-дәрмектің дизайны: Адамның альдоз-редуктаза-ингибиторы кешеніндегі өзара әрекеттесулер туралы ақпарат 0,66 Å», Ақуыздар: құрылымы, қызметі және биоинформатика, 55 (4): 792–804, дои:10.1002 / прот.20015, PMID 15146478
- ^ Yabe-nishimura, C. (1998), «Глюкозаның уыттылығындағы альдоз-редуктаза: диабеттік асқынулардың алдын алудың ықтимал мақсаты», Фармакол Rev., 50 (1): 21–33, PMID 9549756
- ^ Ховард, Э.И .; Санишвили, Р; Кахау, RE; Мичлер, А; Chevrier, B; Барт, П; Ламур, V; Ван Цандт, М; т.б. (2004), «Ультра жоғары рұқсатты препараттың дизайны: 0,66 at кезінде адамның альдозды редуктаза-ингибиторы кешеніндегі өзара әрекеттесулер туралы мәліметтер», Ақуыздар: құрылымы, қызметі және биоинформатика, 55 (4): 792–804, дои:10.1002 / прот.20015, PMID 15146478


