Флуориназа - Fluorinase
| Флуориназа (аденозил-фторид синтазы) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторлар | |||||||||
| EC нөмірі | 2.5.1.63 | ||||||||
| Мәліметтер базасы | |||||||||
| IntEnz | IntEnz көрінісі | ||||||||
| БРЕНДА | BRENDA жазбасы | ||||||||
| ExPASy | NiceZyme көрінісі | ||||||||
| KEGG | KEGG кірісі | ||||||||
| MetaCyc | метаболизм жолы | ||||||||
| PRIAM | профиль | ||||||||
| PDB құрылымдар | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
The фториназа фермент (EC 2.5.1.63, аденозил-фторидті синтаза деп те аталады) катализдейді арасындағы реакция фтор ион және ко-фактор S-аденозил-L-метионин генерациялау L-метионин және 5'-фтор-5'-дезоксиаденозин, фторометаболит биосинтез жолының алғашқы алынған өнімі.[1] Фториназа бастапқыда топырақ бактериясынан оқшауланған Streptomyces chorva, бірақ гомологтар содан кейін бірқатар басқа бактериялық түрлерде анықталды, соның ішінде Стрептомицес sp. MA37, Nocardia brasiliensis және Актинопландар sp. N902-109.[2] Бұл органикалық химиядағы ең күшті жалғыз байланыс, көміртек-фтор байланысының түзілуін катализдеуге қабілетті жалғыз белгілі фермент.[3]

Гомолог хлориназа фтор ионымен емес хлоридпен бірдей реакцияны катализдейтін ферменттен оқшауланған Тропика салиноспорасыбиосинтетикалық жолынан салиноспорамид А.[4]
Реактивтілік
Фториназа ан. Катализдейді SN2 -SAM-ның C-5 'позициясындағы типті нуклеофильді алмастыру, ал L-метионин бейтарап кетуші топтың рөлін атқарады.[5][6] Флюориназа-катализденетін реакция 10-ға дейін деп бағаланады6[6] 10-ға дейін15[7] катализденбеген реакцияға қарағанда жылдамырақ, жылдамдықтың едәуір күшеюі. Осыған қарамастан, фториназа баяу фермент ретінде қарастырылады, а айналым саны (кмысық) 0,06 мин−1.[8] Реакцияға жоғары кинетикалық тосқауыл фторид ионының суда күшті ерігендігімен түсіндіріледі, нәтижесінде еріткіш су молекулаларын сулы фторид ионынан тазартумен, фторидті белсенді аймақ ішіндегі күшті нуклеофилге айналдырумен байланысты жоғары активтену энергиясы пайда болады.
Фториназа катализдейтін реакция қайтымды және 5'-фтор-5'-дезоксиаденозин мен L-метионинді фториназа, SAM және фторид ионымен инкубациялағанда пайда болады.[9] L-метионинді алмастыру Л-селенометионин кері реакцияның жылдамдығын 6 есе күшейтуге әкеледі,[9] ұлғаюына байланысты нуклеофилділік күкірт орталығымен салыстырғанда селен орталығы.
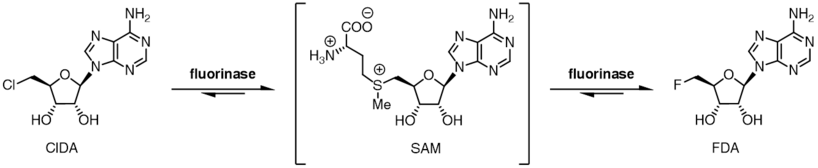
Фториназа галогенді ионға субстратқа төзімділік дәрежесін көрсетеді, сонымен қатар фторид ионының орнына хлорид ионын қолдана алады. SAM мен фторлы ион арасындағы реакция тепе-теңдігі FDA және L-метионин өнімдеріне қатысты болса, тепе-теңдік позициясы хлорид ионында өзгереді. SAM мен хлорид ионын флюориназамен инкубациялау, егер қосымша фермент, L- қоспағанда, 5'-хлор-5'-дезоксиаденозин (ClDA) түзілуіне әкелмейді.аминқышқылдары оксидазасы, қосылды. Аминоқышқыл оксидазасы L-метионинді реакциядан шығарып, оны сәйкес оксо-қышқылға айналдырады.

Галогенді артықшылық, екі реакция тепе-теңдігінің позициясымен бірге, транслалогендеу реакциясын ферменттің көмегімен катализдеуге мүмкіндік береді.[9] 5'-хлорлы нуклеозидтерді ферментпен инкубациялау, каталитикалық L-селенометионинмен немесе L-метионинмен бірге 5-фторлы нуклеозидтер өндіріледі. Қашан [18F] фтор қолданылады, бұл траншалогендеу реакциясы синтезі үшін қолдануға болады радиотрациттер үшін позитронды-эмиссиялық томография.[10][11]
Құрылымдық зерттеулер
2007 жылдың аяғында 9 құрылымдар осы ферменттер класы үшін шешілді PDB қосылу кодтары 1RQP, 1RQR, 2C2W, 2C4T, 2C4U, 2C5B, 2C5H, 2CBX, және 2CC2.
Ферментке берілген атаулар құрылымнан емес, атқаратын қызметінен туындайды: 5-Фтор-5-дезоксиаденозин - синтезделген молекула. Құрылымы гомологты duf-62 ферменттер қатары. Фермент - тримерлердің димері (әрқайсысы үш суббірліктен тұратын 2 молекула). Белсенді учаскелер осы суббірліктердің арасында орналасқан (суббірлік интерфейстері), әрқайсысы бір уақытта бір SAM молекуласымен байланысуы мүмкін.[12]
Фторометаболит биосинтезі
Бұл бөлім бос. Сіз көмектесе аласыз оған қосу. (Қараша 2015) |
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б O'Hagan D, Schaffrath C, Cobb SL, Hamilton JT, Murphy CD (наурыз 2002). «Биохимия: фторорганикалық молекуланың биосинтезі». Табиғат. 416 (6878): 279. дои:10.1038 / 416279a. PMID 11907567.
- ^ Deng H, Ma L, Bandaranayaka N, Qin Z, Mann G, Kyeremeh K, Yu Y, Shepherd T, Naismith JH, O'Hagan D (ақпан 2014). «Геномды қазу арқылы Streptomyces sp MA37, Norcardia brasiliensis және Actinoplanes sp N902-109 флюориназаларын анықтау». ChemBioChem. 15 (3): 364–8. дои:10.1002 / cbic.201300732. PMID 24449539.
- ^ O'Hagan D (ақпан 2008). «Фторорганикалық химияны түсіну. C-F байланысына кіріспе». Химиялық қоғам туралы пікірлер. 37 (2): 308–19. дои:10.1039 / b711844a. PMID 18197347.
- ^ Eustáquio AS, Pojer F, Noel JP, Moore BS (қаңтар 2008). «Теңіз бактерияларына тәуелді SAM-тәуелді хлориназаның ашылуы және сипаттамасы». Табиғи химиялық биология. 4 (1): 69–74. дои:10.1038 / nchembio.2007.56. PMC 2762381. PMID 18059261.
- ^ Cadicamo CD, Courtieu J, Deng H, Meddour A, O'Hagan D (мамыр 2004). «Ферментативті фторлау Streptomyces Chorde-де SN2 реакция механизміне сәйкес конфигурация инверсиясымен жүреді». ChemBioChem. 5 (5): 685–90. дои:10.1002 / cbic.200300839. PMID 15122641.
- ^ а б Senn HM, O'Hagan D, Thiel W (қазан 2005). «QM және QM / MM есептеулерінен ферментативті C-F байланысының пайда болуы туралы түсінік». Американдық химия қоғамының журналы. 127 (39): 13643–55. дои:10.1021 / ja053875s. PMID 16190730.
- ^ Lohman DC, Edwards DR, Wolfenden R (қазан 2013). «Дезоляция арқылы катализ: SAM-тәуелді галоген-алкилдеу ферменттерінің каталитикалық ерлігі». Американдық химия қоғамының журналы. 135 (39): 14473–5. дои:10.1021 / ja406381b. PMID 24041082.
- ^ Чжу Х, Робинсон Д.А., МакЭуан Ар, О'Хаган Д, Нейсмит Дж.Х. (қараша 2007). «Streptomyces chorva ферменттік фторлау механизмі». Американдық химия қоғамының журналы. 129 (47): 14597–604. дои:10.1021 / ja0731569. PMC 3326528. PMID 17985882.
- ^ а б c Deng H, Cobb SL, McEwan AR, McGlinchey RP, Naismith JH, O'Hagan D, Robinson DA, Spencer JB (қаңтар 2006). «Streptomyces chorva-дан алынған флюориназа да хлориназа болып табылады». Angewandte Chemie. 45 (5): 759–62. дои:10.1002 / anie.200503582. PMC 3314195. PMID 16370017.
- ^ Deng H, Cobb SL, Gee AD, Lockhart A, Martarello L, McGlinchey RP, O'Hagan D, Onega M (ақпан 2006). «Флуориназа арқылы C- (18) F байланысының түзілуі, ПЭТ таңбалаудың ферментативті құралы». Химиялық байланыс. 0 (6): 652–4. дои:10.1039 / b516861a. PMID 16446840.
- ^ Томпсон С, Онега М, Эшворт С, Флеминг IN, Пассчи Дж, О'Хаган Д (қыркүйек 2015). «Позитронды-эмиссиялық томография үшін RGD пептидінің делдалдығымен екі сатылы фториназа ферменті (18) F». Химиялық байланыс. 51 (70): 13542–5. дои:10.1039 / c5cc05013h. PMID 26221637.
- ^ Dong C, Huang F, Deng H, Schaffrath C, Spencer JB, O'Hagan D, Naismith JH (ақпан 2004). «Бактериялық фторлы ферменттің кристалдық құрылымы және механизмі». Табиғат. 427 (6974): 561–5. дои:10.1038 / табиғат02280. PMID 14765200.
