Дифенилкетен - Diphenylketene
 | |
 | |
| Атаулар | |
|---|---|
| IUPAC атауы 2,2-Ди (фенил) этенон | |
| Басқа атаулар Дифенилетенон | |
| Идентификаторлар | |
3D моделі (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
CompTox бақылау тақтасы (EPA) | |
| |
| |
| Қасиеттері | |
| C14H10O | |
| Молярлық масса | 194.233 г · моль−1 |
| Сыртқы түрі | Қызыл-қызғылт сары май |
| Еру нүктесі | 8-ден 9 ° C-ге дейін (46-дан 48 ° F; 281-ден 282 K-ге дейін) |
| Қайнау температурасы | 118 мм-ден 120-ға дейін 1 мм с.б. |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
Дифенилкетен Бұл химиялық зат туралы кетен отбасы. Дифенилкетен, көпшілік сияқты кетендер, қызыл-қызғылт сары май бөлме температурасы және қысым. Кетендік құрылымдағы дәйекті қос байланыстың арқасында R1R2C = C = O, дифенил кетен - а гетерокумула. Дифенил кетеннің маңызды реакциясы - бұл [2 + 2] циклдік шығарылым C-C, C-N, C-O және C-S байланыстары кезінде.[1]
Тарих
Дифенил кетен алғаш оқшауланған Герман Штаудингер 1905 ж. және ерекше реактивті класының алғашқы мысалы ретінде анықталды кетендер[2] жалпы R формуласымен1R2C = C = O (R1= R2= фенил тобы).[3]
Дайындық
Х.Штаудингердің алғашқы синтезі 2-хлордифенилацетилхлоридке негізделген (дайындалған гидрокси (дифенил) сірке қышқылы және тионилхлорид[4]) олардан екі хлор атомы бөлінеді мырыш ішінде галогендену реакциясы:[2]

Ерте синтез қолданылады бензилмоногидразон (бастап.) Дифенилетанедион және гидразин гидраты[5]), ол тотығады сынап (II) оксиді және кальций сульфаты моно-диазокетон түзеді, содан кейін азотты жою кезінде 100 ° C температурада дифенилкетенге айналады: 58% кірісте:[6]
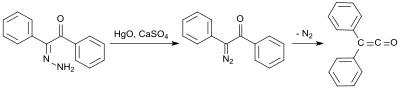
Дифенилкетеннің ерте синтезі 1901 жылы дифенил кетен алған Эдуард Ведекиндтен бастау алады. дегидрохалогенизация дифенилацетилхлоридтің триэтиламин, дегенмен оқшауланусыз және сипаттамасыз.[7] Бұл нұсқаны 1911 жылы Х.Штаудингер де сипаттаған.[8]
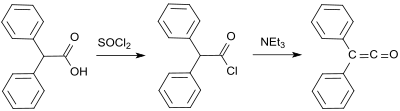
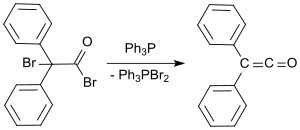
Стандартты зертханалық хаттама Стаудингер әдісіне негізделген және дифенил кетенді апельсин майы ретінде 53-тен 57% -ға дейін береді.[9] Соңғы процесте 2-бром-2,2-дифенилацетил бромидімен реакцияға түседі трифенилфосфин дифенил кетенді 81% дейін өнімділікпен беру.[10]
Жақында дифенил сірке қышқылынан дифенил кетенді синтездеу және Гендриксон реактиві (трифенилфосфониум ангидрид-трифлуорометансульфонат)[11] судың 72% шығымымен шығуы туралы хабарланды.[12]

Қасиеттері
Дифенил кетен бөлме температурасында қызғылт-сарыдан қызылға дейін (концентрацияланған түспен) калий дихроматының ерітіндісі[2]) полярлы емес органикалық еріткіштермен араласады (мысалы диэтил эфирі, ацетон, бензол, тетрагидрофуран, хлороформ )[13] және суықта түзілетін сары кристалдарда қатады.[2] Қоспа ауамен оңай тотығады, бірақ тығыз жабылған ыдыста 0 ° C температурада бірнеше апта бойы ыдыратпай сақтайды[9] немесе аз мөлшерде қосылатын азотты атмосферада гидрохинон полимеризация ингибиторы ретінде.[6]
Реактивтілік
Дифенилкетен иесінің шабуылынан өтуі мүмкін нуклеофилдер, оның ішінде алкоголь, аминдер, және Enolates өте баяу тарифтермен. Болған жағдайда бұл ставкаларды арттыруға болады катализаторлар. Қазіргі уақытта механизм шабуыл жасау белгісіз, бірақ дәл механизмін анықтау бойынша жұмыс жүргізілуде.
Дифенил кетеннің жоғары реактивтілігі үш мөлшердің пайда болуынан да көрінеді:[14]
- циклдік дикетон 2,2,4,4-тетрафенилциклобутан-1,3-дион (I) хинолин
- β-лактон 4- (дименилметилен) -3,3-дифенилоксетан-2-бір (II) натрий метоксиді және
- тетралин туындысы 2,2,4-трифенилнафталин-1,3- (2H,4H) -dione (III) көмегімен қыздыру арқылы бензой хлориді
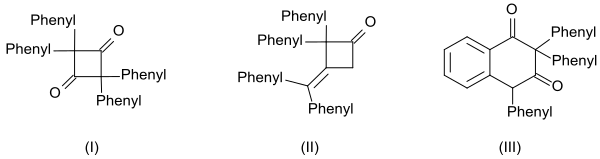
және олигомерлер одан өндірілген.
Қолдану
Кетенес (жалпы формула R1R2C = C = O) -ге көптеген параллельдер бар изоцианаттар (жалпы формуланың R-N = C = O) олардың конституциясында және реактивтілігінде.
Дифенил кетен сумен әрекеттеседі қосу реакциясы қалыптастыру дименил сірке қышқылы, бірге этанол дифенил сірке этил эфиріне немесе аммиакпен тиісті амидке дейін.[2] Карбон қышқылдары дифенил сірке қышқылының аралас ангидридтерін шығарады, оны қорғалған активтендіру үшін қолдануға болады аминқышқылдары үшін пептидтік байланыс.
Қорғалған дипептид Осылайша Z-лейцинді дифенил кетенмен активтендіру және кейіннен фенилаланин этил эфирімен реакциялау арқылы Z-Leu-Phe-OEt (N-бензилоксикарбонил-L-лейцил-L-фенилаланин этил эфирі) 59% кірісте алынады.[15]
Дифенил кетенге бейім тотығу, онда сәйкес полиэфир аралық дифенил ацетолактон арқылы 60 ° C-тан жоғары температурада түзіледі.[16]

Ішінде Виттиг реакциясы, аллен дифенил кетеннен дайындалуы мүмкін.[17]

Трифенилфосфин дифенилметиленмен және дифенил кетенмен, e. ж. 140 ° C және қысыммен тетрафенил аллендері 70% шығуда түзіледі.[18]
Дифенил кетеннің синтетикалық тұрғыдан ең қызықты реакциялары - [2 + 2] циклодридтер, мысалы. реакциясы циклопентадиен Diels-Alder қосымшасын беру.[19]

Елестейді сияқты бензаланилин форма β-лактамдар дифенил кетенмен.
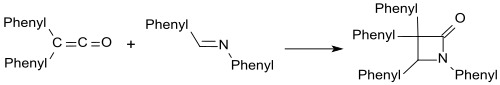
Карбонилді қосылыстармен β-лактондар ұқсас түзіледі.[19]
[2 + 2] дифенил кетеннің фенилацетиленмен циклотекциясы бірінші а-ға әкеледі циклобутенон ол фенил винил кетенге дейін термиялық хош иістендіреді және [4 + 2] циклодукцияда циклда 3,4-дифенил-1-нафтолға 81% кірістілікке айналады.[20]

Смит-Хон деп аталатын реакциядан алмастырылған фенолдар мен хинондардың жалпы синтез әдісі жасалынды.[3]
Әдебиеттер тізімі
- ^ Ульрих, Х. (1967), Гетерокумулендердің циклодридтік реакциялары, Нью-Йорк: Academic Press, б. 374
- ^ а б c г. e Штаингер, Х. (1905). «Ketene, eine neue Körperklasse». Бер. Дтш. Хим. Гес. (неміс тілінде). 38 (2): 1735–1739. дои:10.1002 / cber.19050380283.
- ^ а б Тидуэлл, Т.Т. (2005), «Кетендердің бірінші ғасыры (1905-2005): реактивті аралық өнімдердің жан-жақты отбасының тууы», Angew. Хим., 44 (36), 5778-5785 б., дои:10.1002 / anie.200500098, PMID 16149113
- ^ Король, Ф.Е .; Холмс, Д. (1947), «Синтетикалық мидриатика. Дифенилхлорацетилхлорид үшінші амино-спирттердің бензил эфирлерін дайындауға арналған реагент ретінде», Дж.Хем. Soc., 164–168 б., дои:10.1039 / JR9470000164, PMID 20238643
- ^ Керциус, Т .; Тун, К. (1891), «Einwirkung von Hydrazinhydrat auf Monoketone und Orthodiketone», Дж. Практ. Хим., 44 (2), 161-186 бб, дои:10.1002 / прак.18910440121
- ^ а б Смит, Л.И .; Хоэн, Х.Х. (1940). «Дифенилкетен [Кетен, дифенил-]». Органикалық синтез. 20: 47. дои:10.15227 / orgsyn.020.0047.; Ұжымдық көлем, 3, б. 356
- ^ Wedekind, E. (1901), «Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen», Бер. Дтш. Хим. Гес., 34 (2), 2070–2077 б., дои:10.1002 / сбер.190103402122
- ^ Стаудингер, Х. (1911), «Über Ketene.XIX. Über Bildung und Darstellung des Diphenylketens», Бер. Дтш. Хим. Гес., 44 (2), 1619-1623 б., дои:10.1002 / сбер.19110440258
- ^ а б Тейлор, Э.С .; Маккиллоп, А; Хоукс, Г.Х. (1972). «Дифенилкетен [Этенон, дифенил-]». Органикалық синтез. 52: 36. дои:10.15227 / orgsyn.052.0036.; Ұжымдық көлем, 6, б. 549
- ^ Дарлинг, С.Д .; Кидуэлл, Р.Л. (1968), «Дифенилкетен.. Трифенилфосфинді галогенизация.. Ал-бромодифенилацетил бромид», Дж. Орг. Хим., 33 (10), 3974–3975 б., дои:10.1021 / jo01274a074
- ^ Макколи, Дж. (2012), «Гендриксон реагенті (трифенилфосфониум ангидрид трифлуорметан сульфонат» », Синлетт, 23 (20), 2999–3000 б., дои:10.1055 / s-0032-1317486
- ^ Мусса, З. (2012), «Гендриксон» POP «реактиві және олардың аналогтары: синтез, құрылым және органикалық синтезде қолдану», Аркивок, 2012 (1): 432–490, дои:10.3998 / ark.5550190.0013.111
- ^ Лихи, Дж. (2001). «Дифенилкетен». Органикалық синтезге арналған реагенттер энциклопедиясы. дои:10.1002 / 047084289X.rd421. ISBN 0471936235.
- ^ Дас, Х .; Kooyman, E. C. (1965). «Дифенилкетеннің олигомерлері». Recueil des Travaux Chimiques des Pays-Bas. 84 (8): 965–978. дои:10.1002 / recl.19650840802.
- ^ Лоссе, Г .; Демут, Э. (1961), «Diphenylketen als Reagens zur Knüpfung von Peptidbindungen», Бер. Дтш. Хим. Гес. (неміс тілінде), 94 (7), 1762–1766 бб, дои:10.1002 / сбер.19610940713
- ^ Штадингер, Х .; Дайкергоф, К .; Клевер, Х.В .; Ruzicka, L. (1925), «Über Autoxidation Organischer Verbindungen. IV.: Über Autoxidation der Ketene», Бер. Дтш. Хим. Гес. (неміс тілінде), 58 (6), 1079–1087 бб, дои:10.1002 / cber.19250580618
- ^ Виттиг, Г .; Haag, A. (1963), «Über Phosphin-alkylene als olefinbildende Reagenzien, VIII. Allelderivate aus Ketenen», Бер. Дтш. Хим. Гес. (неміс тілінде), 96 (6), 1535–1543 бб, дои:10.1002 / cber.19630960609
- ^ Люшер, Г. (1922). Beitrag zur Konstitution der aliphatischen Diazokörper und Hydrazone. Neue organische Phosphorverbindungen (PDF) (Докторлық диссертация) (неміс тілінде). Eidgenössische Technische Hochschule Цюрих. дои:10.3929 / ethz-a-000096667. hdl:20.500.11850/134328.
- ^ а б Штаингер, Х. (1907), «Zur Kenntnis der Ketene. Diphenylketen», Либигс Анн. Хим. (неміс тілінде), 356 (1-2), 51–123 б., дои:10.1002 / jlac.19073560106
- ^ Смит, Л.И .; Хоэн, Х.Х. (1939), «Дифенилкетен мен фенилацетиленнің реакциясы», Дж. Хим. Soc., 61 (10), 2619–2624 б., дои:10.1021 / ja01265a015

![{displaystyle {ce {(фенил) 2C = C = O -> [{} үстіңгі {Z-Leu}}] (фенил) 2CO-O-CO - {}}} {ext {Z-Leu}} { ce {-> [{} {ce {H-Phe-OEt}}]}} {ext {Z-Leu}} {ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)